К фотометрическому методу определения пероксидазы и полифенолоксидазы в листьях и побегах винограда
При помощи этой методики, применяемой в нашей лаборатории долгие годы, определяется не только активность водорастворимой часты оксидаз, которая обычно составляет меньшую часть общей суммы ферментов в ткани, но и активность основной части ферментов, находящихся в клетках в адсорбированном виде на хлоропластах или других структурных элементах клеток.
Принцип метода заключается в фотометрическом определении количества пурпурогаллина, образованного после кратковременного воздействия ферментного препарата на раствор пирогаллола в присутствии или без нее (с Н2О2 определяется пероксидаза и полифенолоксидаза, а без H2O2 - только полифенолоксидаза). Ферментным препаратом служит препарат листа, предварительно обработанный ацетоном.
Приготовление ацетонового препарата. Тормозящее действие различных веществ листа на активность ферментов ликвидируют многократной обработкой охлажденным ацетоном до удаления пигментов, фенольных и других растворимых в ацетоне веществ. Для этого на технических весах взвешивают 1,5-2 г листьев из среднего образца, помещают в фарфоровую скупку и растирают. Заливают ацетоном, хорошо перемешивают, пестик снимают. Через 1—2 минуты ацетон осторожно сливают через бумажный фильтр. Обработку повторяют 5-6 раз до полного обесцвечивания осадка. Затем осадок высушивают при комнатной температуре до полного удаления следов ацетона. Полученный осадок служит в качестве ферментативного препарата (свободного и связанного) и сохраняет свою активность в течение недели при хранении в холодильнике.
Ход определения. Обесцвеченный ферментативный препарат растирают в ступке до состояния пудры. На торзионных весах отвешивают 4 навески по 200 мг и количественно пересыпают в 50 мл сухие мерные колбы. Туда вливают пипеткой до 10 мл 1—процентного раствора пирогаллола, стараясь промыть горлышки кол- бочек. В Две колбы прибавляют микропипеткой по 2 мл 0,5-процентной H2O2 (для определения суммы пероксидазы и полифенолоксидазы), в другие две - 2 мл воды (для определения только полифенолоксидазы). Смесь оставляют на 10 минут при температуре 25 С, после чего реакцию приостанавливают прибавлением 5 мл 20-процентной H2SO4. Сразу же по окончании реакции образовавшийся окрашенный желтый продукт - пурпурогаллин—переводят в эфир. Для этого в колбу до метки доливают охлажденный в холодильнике серный эфир и взбалтывают резкими движениями, в результате чего весь пурпурогаллин переходит в эфир, а нижний слой обесцвечивается. Иногда, в зависимости от сорта, нижний спой окрашивается в красный цвет, но он не переходит в эфир и не мешает дальнейшему ходу определения. Эфирный раствор подвергается фотометрическому промеру (ФЗК-Н) при волне 470 мм (синий фильтр) в кюветах толщиной 10 мм. Количество пурпурогаллина, образовавшегося в колбочке без Н202,является суммарной активностью полифенолоксидазы и пероксидазы, а разность обоих определений показывает активность пероксидазы. Перед фотометрированием колбочки ставят в холодильник, достают по мере измерения и быстро фотометрируют в закрытых кюветах.
Вычислительную таблицу составляют по чистому пурпурогаллину, но при его отсутствии можно использовать в качестве стандарта раствор С2O7 (0,75 г в 1 л 0,5 н. HCl ).
Этот раствор по интенсивности окраски соответствует 0,01% раствора пурпурогаллина в эфире.
В прилагаемой вычислительной таблице дана дополнительная графа, куда выписывают величину активности ферментов (в мг за 10 минут на 1 г ацетонового порошка), если определение проведено в 200 мг навески в 50 мл мерных колбах (как указано в методике).
В случае высокой активности ферментов, когда концентрация эфирного раствора выходит за пределы шкалы, нужно уменьшить навеску (но брать не менее 100 мг) или увеличить объем эфирного раствора разбавлением.
Таблица активности оксидаз (при волне 470 M^t в 10 мм кюветах)

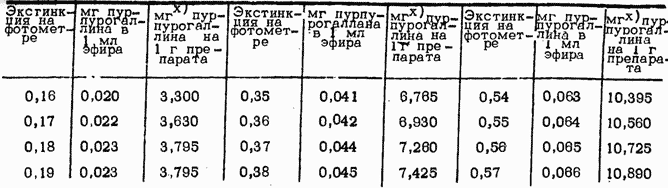
х* При навеске 200 мг в 500 мл колбах, где весь образовавшийся пурпурогаллин переведен в 33 мл серного эфира.

