Жиры являются одной из важных составных частей протоплазмы живых клеток растений. Они используются и накапливаются в качестве запасных питательных веществ, особенно много их в органах размножения: в семенах и плодах. Вегетативные части редко содержат больше 5%, обычно содержание жиров колеблется в пределах 2-3%. Кора содержит больше жиров, чем древесина. Самое большое количество жиров было обнаружено в флоэме и сердцевинных лучах ветвей. В корнях содержатся следы жиров. Большое количество их обнаружено в почках в период покоя.
У большинства растений в содержании жиров отмечаются сезонные колебания: их количество увеличивается зимой и уменьшается летом. Так, например, Генкель и Окнина (1848), Ульрих и Другие (1961) показали, что под влиянием низких отрицательных температур накапливаются жиры в тканях растений, а исчезновение крахмала зимой некоторые исследователи связывают с накоплением жиров. Муромцев, Локонова и другие (1961) отмечают, что клетки, лишенные жира, легче повреждаются холодом. Иванов (1946), Мак-Нээр (1843) показали, что холод влияет не только на количество жиров, но меняет также их качество: происходят глубокие изменения в составе жиров, увеличивается количество ненасыщенных жирных кислот, Штумпф и другие (1962), напротив, в опытах по синтезу жиров нашли с помощью митохондрий, что относительно низкие температуры приводят к накоплению насыщенных жирных кислот. Таким образом, вскрытие закономерностей превращения жиров в побегах плодовых растений под воздействием холода является чрезвычайно важным звеном обмена веществ при изучении проблемы зимостойкости.
Нами в условию мягкой зимовки 1962/63 г. и крайне суровой зимы 1963/64 г. (для Армении) было проведено микрохимическое и хроматографическое изучение жирового обмена некоторых плодовых культур (персика, абрикоса и винограда). Для проведения этой работы нами разработана схема.

на бумаге, пропитанной керосином (230-260°); разделение разных жирных кислот на бумаге, пропитанной вазелиновым маслом; разделение ненасыщенных кислот на бумаге, пропитанной вазелиновым маслом.
В зависимости от задачи исследования можно проводить изучение только свободных или же связанных жиров, или обеих фракций вместе. Для этого нужно проводить соответствующую экстракцию. Дальнейшие исследования составных компонентов жиров уже проводят по общей методике на экстрактах связанных и свободных жиров.
Экстракция свободного жира. Взвешивают 10 г порошка в патронах из фильтровальной бумаги в стаканах Сокслета. Экстракцию проводят 12 часов в аппарате Сокслета петролейным эфиром на водяной бане. Сгущенный экстракт переводят количественно петролейным эфиром в 100 мл мерную колбу с притертой пробкой и так храпят в холодильнике для дальнейших анализов.
Экстрация связанного жира. Освободившийся от свободных жиров материал в стаканах Сокслета высушивают в вакуум-аппарате при 33 С. Затем 12 часов гидролизовали спиртом (95 ) в том же аппарате Сокслета на закрытой электроплитке. После этого спирт отгоняют до 1/4 емкости и заливают серным эфиром До прежнего объема. Теперь экстрагируют 12 часов смесью серного эфира и спирта(3: 1). Спирт-эфирный растворитель отгоняют, экстракт на дне колбы подвергают многократному извлечению петролейным эфиром. Все порции промывной жидкости фильтруют через стеклянный фильтр N° 1 в 100 мл мерные колбы и хранят в холодильнике до анализов.
Химические методы исследования
- . Определение сырого жира (растворимая в ролейном эфире фракция).
Берут 20 мл вытяжки в коническую колбу емкостью 50 мл с притертой пробкой, высушивают в вакуум-сушилке при 20-30С* взвешивают на аналитических весах.
% сырого жира
на сухой вес![]()
где а - вес колбы и сухой остаток, г;
б - вес колбы,, г;
Н - навеска, г;
В - влажность, %.
- . Определение свободных жирных кислот. Берут
- мл вытяжки высушивают в вакуум-сушилке при 20- 30°С. Остаток растворяют в 5 мл теплого этилового спирта и в присутствии одной капли индикатора нильский голубой (0,1%) титруют 0,01 н. аОН в атмосфере азота. Вычисление процента свободных кислот (по олеиновой кислоте) производят следующим образом:
![]()
где а - мл 0,01 н. МаОН,
х -свободные жирные кислоты( на сухой вес),%.
- Определение триглицеридов. Берут 5 мл из петролейноэфирного экстракта в 25 мл бюкс, высушивают в вакуум-сушилке при 20-30 С, заливают 5-7 мл ацетона, смешивают палочкой до растворения большей части материала, ставят на 1 час в морозильник холодильника. Затем фильтруют в 50 мл мерную колбу, доводят до метки петролейным эфиром. Из I этого раствора берут 10 мл в пробирку с притертой пробкой. Растворитель испаряют в вакуум-сушилке при 20-30 С.
Одновременно в такой же пробирке испаряют 1 мл стандартного раствора тримкристина (1 мг/1 мл).
Обе пробирки заливают 3 мл спирт-эфирного растворителя (3:1). После растворения остатка прибавляют 1 мл раствора гидроксила мина, 0,4 мл раствора хлорного железа, через 20 минут прибавляют 0,6 мл 4 н. НCL , слабо перемешивают. Прибавляют 1 мл спирт-эфирного растворителя, и измеряют на волне 520 мм на обыкновенном фотоэлектроколориметре.
Реактивы. 1. Раствор спирт-эфира (3 части спирта, 1 часть эфира), взбалтывают и хранят в холодильнике.
- Раствор гидроксилами на (раствор А) - 13,0 г гидроксиламина солянокислого растворяют в дистиллированной воде и доводят до 100 мл.
Раствор Б - 14,0 г NaOH растворяют в 50 мл воды и объем доводят до 100 мл.
Перед употреблением смешивают растворы А и Б в равных объемах.
- Раствор НС£ 4 н. - 1 мл концентрированной НС& , 2 мл воды.
- Стандартный раствор тримкристина - 1 мг в
- мл. Вычисляют по формуле:
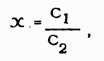
где х - мг триглицеридов в 1 мл вытяжки в петролейном эфире,
C1 - оптическая плотность (на красной шкале фотометра) для исследуемого раствора,
С2 - оптическая плотность для стандартного раствора.
Для пересчета триглицеридов в процентах на сухой вес нужно воспользоваться уравнением
![]()
где Н - навеска экстрагированного вещества, г;
В - влажность, %,
х - мг. триглицеридов в 1 мл петролейно-эфирной вытяжки.
- Определение фосфолипидов. 5 мл из петролейного экстракта выпаривают в 50мл или в 100 мл колбе Кьельдаля на водяной бане, 5 мл смеси серной и азотной кислот (1:1) и подвергают мокрому сжиганию. Когда жидкость в колбе становится прозрачной, осторожно приливают 30 мл дистиллированной воды (в колбу бросают кусочки капилляра) и выпаривают воду до тех пор, пока пары не будут иметь запаха азотной кислоты. После сжигания жидкость переносят в 100 мл мерную колбу. Туда же прибавляют 20 мл раствора молибдата аммония и 20 мл восстановителя. Одновременно в такую же колбу на 3 мл стандартного раствора прибавляют 10 мл серной кислоты (3:1), 20 мл раствора молибдата аммония, 20 мл восстановителя. Обе колбы закрывают пробками и ставят в Термостат при 30-40 С на час, потом колориметрируют при волне 630 мм на фотометре (ФЭК-56, фильтр 9).
Реактивы. 1. Стандартный раствор - 0,3833 г KН2PO4 растворяют в 1 л дистиллированной воды (одна—две капли толуола предохраняют раствор от плесени). 1 мл этого раствора имеет 0,08732 мг фосфора (3 мл стандартного раствора содержат 0,251.96 мг фосфора).
- Раствор молибдата аммония - 25 г реактива (х.ч.) растворяют в 1 л дистиллированной воды. Хранят в темной склянке с притертой пробкой.
- Раствор восстановителя в 100 мл дистиллированной воды растворяют 1 г гидрохинона, 15 г бисульфата
![]()
где С 1 - концентрация фосфора в испытуемом растворе (красные цифры фотометра);
С2 - концентрация фосфора в стандартном растворе.
Причем % фосфолипидов на сухой вес равен
- Йодное число. В коническую колбу с сухим остатком, который служит для определения сырого жира, заливают 2,5 мл хлороформа, который растворяет остаток на дне и стенках колбы. Закрывают пробкой и оставляют в покое на 20 минут, затем прибавляют 3 мл раствора Гануса, колбу закрывают пробкой и ставят в темноту на 1,5 часа. Потом прибавляют 5 мл 20-процентного раствора К йод, 10-20 мл воды и титруют гипосульфитом (н/10) при непрерывном взбалтывании, в присутствии 1-процентного раствора крахмала.
Для внесения поправки на растворы ставят слепой опыт без жирового экстракта. Вычисляют по формуле:
![]()
где A 1 - расход мл гипосульфита натрия на контрольную пробу;
A2 - расход мл гипосульфита натрия на исследуемую пробу;
Р — навеска жирового вещества.
Хроматографические методы исследования жиров
- Разделение моно-, ди-, триглицеридов на тонком слое кремниевой кислоты(М.А.Муромцев, В.И.Локонова,,1961) Используется специальная кремниевая кислота для хроматографии - 200 меш. За неимением можно использовать химически чистую кремниевую кислоту после измельчения до тонкого порошка (0,1 мм) активизируется 24 часа при 120 С. Для нанесения на стекло (9x16 см) слоя толщиной в 3 мм необходимо иметь 60 г кремниевой кислоты и 1,2 г медицинского гипса. Кремниевую кислоту и гипс перемешивают в фарфоровой ступке, сразу добавляют 50 мл воды и опять перемешивают. Затем постепенно прибавляют еще 30 мл оды (всего 80 мл). Этой смесью можно покрыть стекло разными способами. Слой на стекле сушится коло 12 часов сначала при комнатной температуре, по- ом 3 часа в шкафу при 120 С.
Берутся 2 мл из первоначального экстракта в петролейном эфире в 10 мл пробирку, отгоняют растворитель в вакуум-сушилке при 20-30 С, потом прибавляют 1 мл ацетона и пробирку ставят на 1 час в морозильник холодильника. Из ацетонового раствора используют 0,25-0,5 мл (около 1500-3000 гамма), который наносят в 2 см от нижнего края покрытого споем стекла. Хроматографируют восходящим двуступенчатым методом. Для этого используют 2 батарейные камеры 20х10x10 см. Первую ступень хроматографии проводят около 35 минут в смеси петролейного эфира, серного эфира и уксусной кислоты (90:10:1). Вторую ступень - после сушки хроматограммы при комнатной температуре в течение 20 минут опять в смеси петролейного, серного эфира и уксусной кислоты (40:60:1). Хроматограмму сушат при комнатной температуре. Проявление проводят в парах йода при 60 . Для идентификации глицеридов одновременно с исследуемым раствором наносят и метчики моно-, ди-, триглицеридов.
- Разделение разных триглицеридов на бумаге, пропитанной керосином (230-260 ). Ленты (4x28 см или 3x28 см) хроматографической медленной бумаги погружают в 5-процентный ацетоновый раствор керосина , потом слабо высушивают на воздухе. Пропитанные бумаги вставляют между двумя стеклами, 2 мл из петролейного экстракта сгущаются в вакууме до 0,5 мл и пробу наносят на линию старта в 2,5 см от нижнего края бумаги. Хроматографию проводят в специальных цилиндрах диаметром 5 см и длиной в восходящем потоке - 25 см. Растворителем служит смесь 30 мл ледяной уксусной кислоты и 70 мл ацетона, насыщенного керосином (230-260 ). На каждую хроматограмму используют 5 мл этого раствора. Разгонку производят приблизительно в течение 12 часов при 20 С. После этого ленты промывают сперва дистиллированной водой, потом водопроводной и сушат 5-10 минут при 50-70 С. Хроматограммы погружают на 1 минуту в раствор черного судана (70-процентный раствор спирта, насыщенный черным суданом). После стекания для осветления фона хроматографические ленты многократно погружают в 50—процентный этиловый спирт.
- Разделение жирных кислот на бумаге, пропитанной вазелиновым маслом. Берут 5 мл петролейного экстракта в 20 мл пробирку. Эфир отгоняют в вакууме при 20-30 Прибавляют 5 мл 95-процентного этанола и бросают кусочки капилляра. Погружают на 10 минут в кипящую водяную баню, потом прибавляют 2 мл спиртовой щелочи (к 10 г КОН прибавляют 20 мл воды; берут из этого раствора 5 мл, смешивают с 75 мл этилового спирта) и пробирки оставляют в бане до конца отгонки жидкости. После охлаждения остаток подкисляют 1 мл раствора серной кислоты. Нагревают еще 20 минут. Охлаждают и прибавляют 15 мл бензола закрывают пробирку притертой пробкой и сильно встряхивают в течение 30 минут. Для хроматографирования используют бензольный слой.
Необходимо предварительно обработать бумагу. Для этого через ленты 3x30 см медленной хроматографической бумаги пропускают 50-процентную уксусную кислоту в нисходящем потоке, потом высушивают и пропитывают в восходящем потоке 7-10- процентным бензольным раствором чистого вазелинового масла. После испарения бензола на воздухе исследуемые пробы (около 1500 мг жирных кислот) наносят на бумагу в 3 см от нижнего края. Хроматографию проводят в восходящем потоке смесью уксусной кислоты (98%)? муравьиной кислоты (85%) и воды (75:25:2,5).
Для получения собранных пятен без хвостов можно использовать также ступенчатый метод восходящей хроматографии. Первую ступень проводят 90-процентной уксусной кислотой и 85-процентной муравьиной кислотой (3:1); вторую ступень - 98-процентной уксусной и 85-процентной муравьиной кислотой (3:1). После сушки хроматограмму промывают дистиллированной водой и погружают на 30 минут в насыщенный раствор азотнокислого висмута, потом снова промывают водой и погружают в 0,2-процентный раствор Na2S. Полученные пятна сравнивают с метчиком жирных кислот.
- Разделение ненасыщенных жирных кислот на бумаге, пропитанной вазелиновым маслом. Работу проводят, как в разделе 3. Хроматограммы проявляют 0,1- процентным раствором КМпО4 в течение 1,5 минут, после чего их переносят в кюветы и отмывают водой. На белом фоне получают коричневые пятна ненасыщенных кислот.
Хроматограммы разных триглицеридов и жирных кислот можно подвергнуть количественному промеру на денситометре.

