Оксидоредуктазами, или иногда просто оксидазами, называют различные ферменты, которые катализируют реакции биологических окислительно-восстановительных процессов. Их подразделяют на два основных типа: трансгидрогеназы, или гидрогентрансферазы, которые катализируют перенос водорода с одной молекулы на другую, и оксигентрансферазы, которые катализируют фиксацию кислорода на субстрате. Именно ко второму типу и принадлежат оксидоредуктазы, достоверно характеризуемые в винограде, в частности тирозиназа и лакказа. Комиссией по ферментам Международного союза биохимии дано им следующее определение: «они используют дифенолы и другие близкие к ним вещества в качестве доноров (электронов), с одной стороны, и молекулярный кислород как акцептор — с другой» (Диксон и Уэбб, 1964). Эта группа, которая содержит кроме того, аскорбиноксидазу, характеризуется присутствием меди, связанной с молекулой белка.
В отношении винограда Лаборд (1896) первым констатировал, что основной источник оксидазы, ответственной за оксидазный касс, находится в гнили винограда и утверждение Мартинана (1895а, 1895b) о присутствии оксидазы в винограде не показательно. Опубликованные в последующие годы многочисленные работы по этому вопросу, относящиеся к оксидазе виноградной ягоды, не позволяют объяснить разницу в поведении между здоровым и гнилым виноградом в отношении оксидазного касса. Полную библиографию этих работ можно найти в разработках Дейбнера и Рифан (1963) и Пу (1967). Кроме того, сообщалось о присутствии других оксидоредуктаз: пероксидазы (Касиньяр, 1963; Иванов и Иванова, 1968; Пу и Урнак, 1972) и каталазы (Пу, 1967). Но похоже, что роль последнего фермента очень ограничена. Недавние работы, выполненные в Бордо (Дюберне и Риберо-Гайон, 1973а, 1973b, 1974а, 1974b), позволили прояснить эту проблему. Четко различаются две оксидоредуктазы: тирозиназа, которая присутствует во всех ягодах, и лакказа, специфическая для гнили, вызываемой Botrytis cinerea. Различия в активности этих двух ферментов позволяют объяснить разницу в поведении здорового винограда и винограда с гнилью в отношении оксидазного касса.
Нужно также отметить, что широко используемый в энологии термин «полифенолоксидаза» следует рассматривать как синоним тнрозиназы, и объединение тирозиназы и лакказы под общим названием «полифенол оксидаза» создает риск введения в терминологию дополнительных неточностей. Поэтому авторы будут избегать употребления термина «полифенолоксидаза», а будут использовать название «тирозиназа» для фермента винограда и название «лакказа» для фермента, выделяемого грибом Botrytis cinerea.
Тирозиназа винограда
Этот фермент, открытый в конце прошлого века (Бертран, 1896b, 1896с; Буркело, 1896а, 1896b, 1896с), стал предметом очень многих работ. Число растительных и животных видов, в которых была обнаружена тирозиназа. очень велико. Описание источников тирозиназ можно найти в разработках
Даусона и Тарили (1951) и в докторской диссертации Дюберне (1974).
Активность фермента. Тирозиназа обладает двумя видами активности, соответствующими окислению кислородом двух различных групп фенольных соединений:
1. Активность о-дифенольная, вызывающая образование о-хинона; речь идет о катехолазной активности тирозиназы
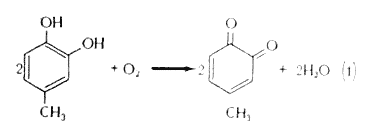
2. Активность монофенольная, ведущая через гидроксилирование к образованию о-дифенола; речь идет о крезол азной активности тирозиназы

Затем о-дифенол окисляется в о-хинон по формуле (1), и крезолазную активность тирозиназы можно записать следующим образом (Мальмстрем и Риден, 1968):
Но окисление о-дифенолов тирозиназой не останавливается на о-хиноне, оно завершается образованием полиме-рнзованных соединений сложной структуры с коричневой окраской — меланинов. Мазон (1955) дал полный перечень соединений, реагирующих с хинонами. Дюберне (1974) исследовал механизмы активности тирозиназы (а также лакказы) и указал на большую сложность проблемы, так как о-хиноны, будучи мощными восстановителями, могут окислять натуральные вещества или вещества, добавляемые в сусло, чтобы возвратиться в положение о-дифенола и снова участвовать в ферментативном окислении, когда весь окислитель будет израсходован (Кордонье, 1971).
Многочисленные работы показали, что тирозиназа связана с хлоропласта-ми у многих видов растений и, особенно в винограде vitis vinifera (Гарел и Мейер, 1971).
Экстракция фермента. Чтобы исследовать тирозиназу винограда и измерить ее активность, необходимо приготовить неочищенный экстракт фермента, метод получения которого должен быть возможно более простым и быстрым, воспроизводимым, стабильным, по крайней мере, в течение некоторого времени. Экстракт фермента не должен содержать полифенолов и должен иметь максимальную активность.
Из двух методов приготовления неочищенного экстракта, применяемых на практике, тот, в котором предусматривается приготовление ацетонового порошка (Пу, 1966), неудобен, так как не дает достаточно стабильного экстракта, в то же время при этом способе происходит одновременная экстракция тирозиназы и лакказы, когда последняя присутствует.
Метод, описанный Гарелем и Мейером (1971), был несколько упрощен Дюберне (1974) с целью сокращения продолжительности процесса экстракции, чтобы ограничить денатурацию фермента и облегчить сравнение большого числа партий винограда.
Принятая схема 1 выделения неочищенного экстракта фермента тирозинадзы приведена ниже. Исходные растворы: 50 г винограда при —20°С +100 мл.
Схема 1
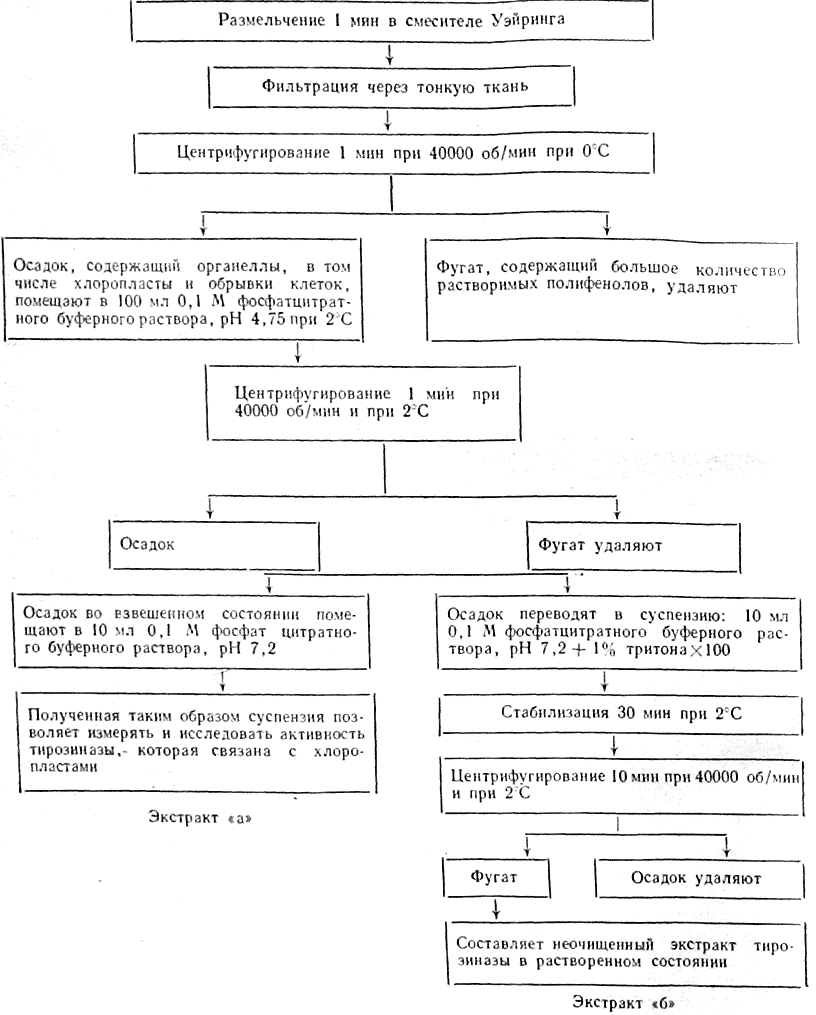
0,1 М фосфатцитратного буферного раствора, рН 7,2 при 20°С + 200 мг аскорбиновой кислоты.
Активность частиц на 1 г свежей массы винограда четырех экстрактов, полученных из одной и той же партии винограда сорта Мальбек (Дюберне, 1974), приведена ниже.
Номера экстрактов 12 3 4
Активность частый, ед. 1940 1970 2080 1850
Очистку сырого экстракта никогда не удавалось сделать полной вследствие изменений структуры, которым подвержена тирозиназа винограда. С другой стороны, частичная очистка, позволяющая исследовать её методами электрофореза или электрофокусирования, возможна (Дюберне, 1974).

