Применяя электрофорез на акриламидном геле по способу Девиса (1964) и Орнштейна (1964) и используя миграцию при низкой температуре (4°С) под напряжением 80 В в течение около 2 ч в присутствии бромфенолового синего как индикатора миграции, констатируют, что свежий экстракт (менее 8 дней), очищенный от тирозиназы винограда, представляет две зоны, быстро перемещающиеся в направлении отрицательного полюса, каким бы ни был использованный сорт.
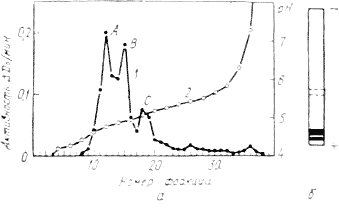
Рис. 2.4. Электрофокусирование (а) и электрофорез (б) свежеприготовленного экстракта тирозиназы винограда (Дюберне и Риберо-Гайон, 1974 г):
1 — активность тирозиназы; 2 —значения рН.
При способе электрофокусирования, который заключается в создании градиента рН для определения изоэлектрических точек белковых молекул, эти же самые свежие очищенные экстракты показывают активность, разделенную на три пика /1, В и С, которые соответствуют изоэлектрическим точкам рН 4,7; 4,9 и 5,1 (рис. 2.4).
Такие же определения, проводимые на неочищенных экстрактах, хранящихся до очистки в течение 2—3 мес при температуре 4°С, показывают при электрофорезе несколько зон с медленной миграцией и два дополнительных пика D и Е изоэлектрических точек рН 5,5 и 6,0 с исчезновением пика С при электрофокусировании (рис.  2.5).
2.5).
Рис. 2.5. Электрофокусирование (а) и электрофорез (б) экстракта тирозиназы после трех месяцев хранения при температуре 4°С (Дюберне и Риберо-Гайон, 1974г): 1 — активность тирозиназы; 2— значения рН.
Эти зоны, в которых молекулы имеют одинаковую молекулярную массу, можно свести к одной ферментативной молекуле, способной выдержать необратимые превращения на уровне своей структуры, превращения, которые не соответствуют «изменениям конформации», описанным Лернером и сотрудниками (1972). Похоже, что эти превращения, часто сопровождающиеся активацией фермента, происходят на уровне наиболее неустойчивых участков цепи в молекуле белка.
Специфичность фермента. В табл. 2.1 даны значения активности, полученные на различных фенольных субстратах при использовании полярографического метода (температура 25°С, рН 4,75, концентрация фенольных веществ 10 мМ).
Можно констатировать, что все о-дифенолы, не замещенные в положении 3, будут окислены,. n-дифенолы, м-дифенолы и монофенолы не являются субстратами этого фермента. Нужно также заметить, что эти опыты проводились с экстрактами солюбилизированной тирозиназы. Таким образом, солюбилизация ведет к тому, что фермент утрачивает свою крезолазную активность.
Таблица 2.1 Активность тирозиназы винограда (Дюберне, 1974)
Группа фенольных соединений | Название фенольных соединений | Активность % |
о-Дифенолы | Метил-4-пирокатехин | 100 |
Пирокатехин | 25 | |
ДОПА | 23 | |
Протокатеховая кислота | 12 | |
Кофейная кислота | 27 | |
Хлорогеновая кислота | 106 | |
(+)-Катехин | 49 | |
о-Дифенол, замещенный в положении 3 | Метил-З-п прокатехин | 0 |
о-Трифенол | Галловая кислота | 8 |
м-Дифенол | Флороглюцин | 0 |
Монофенолы | л-Крезол | 0 |
Тирозин | 0 | |
л-Оксибензойная кислота | 0 | |
Ванилиновая кислота | 0 | |
л-Кумаровая кислота | 0 | |
Феруловая кислота | 0 | |
n-Дифенол диамин | Гидрохинон n-Фенилендиамин Аскорбиновая кислота Танины (лейкоантоцианы) Антоцианы винограда | 0 0 0 |

