УДК: 634.22 : 581.143.6
КУЛЬТИВИРОВАНИЕ IN VITRO И РЕГЕНЕРАЦИЯ ИЗ СОМАТИЧЕСКИХ ТКАНЕЙ СЛИВЫ ДОМАШНЕЙ
С.А. Муратова
ГНУ Всероссийский НИИ генетики и селекции плодовых растений им. И.В. Мичурина, г. Мичуринск
Определены условия культивирования in vitro и адаптации к открытому грунту для ряда районированных и перспективных сортов сливы домашней. Выявлены особенности поведения изучаемых сортов в условиях стерильной культуры. Изучен морфогенезический потенциал девяти сортов сливы. Достигнута регенерация целых растений из изолированных соматических тканей сортов сливы отечественной селекции с частотой до 80-85 %. Определена существенность влияния на эффективность регенерации отдельных факторов, таких как генотип растения, минеральный и гормональный состав среды, источник и концентрация углерода, тип экспланта и его расположение на питательной среде.
Протокол воспроизводимой системы регенерации сливы из изолированных соматических тканей требуется для проведения исследований по различным направлениям биотехнологии, включая соматическую гибридизацию, клеточную селекцию, генную инженерию. Прогресс, достигнутый в этом направлении, будет способствовать применению методов биотехнологии в селекции сливы, что, в конечном счете, приведет к созданию сортов с качественно новыми признаками, которые трудно или невозможно получить методами классической селекции.
Работы различных исследователей по органогенезу в кулмуре тканей косточковых показали, что успех зависел прежде всего от морфогенетического потенциала генотипа, типа экспланта, состава питательной среды и, в первую очередь, вида, соотношения и концентрации используемых регуляторов роста растений. S. Mante, R. Scorza и J.M. Cordts [1] достигли высокой частоты регенерации побегов из незрелых семядолей Primus persica и зрелых семядолей Primus domestica и Prunus cerasus, впервые использовав при регенерации Prunus в качестве вещества с цитокининовой активностью синтетический регулятор роста N-фенил-N'-1,2,3-тидиазолил-5-мочевину (тидиазурон), эффективность которого к тому времени была показана на ряде растительных объектов. Установленное соотношение регуляторов роста в питательной среде достаточно успешно применено в последующих исследованиях при регенерации из гипокотилей сливы [2,3], при регенерации из листовых эксплантов Prunus domestica [4, 5], двух клонов абрикоса и нескольких клонов сливы [6], Prunus serotina и P.avium [7], абрикоса сорта Helena» [8]. В работах по индукции морфогенеза из соматических тканей Prunus изучали влияние на эффективность регенерации минерального состава среды [6], источника углевода [9], ориентации эксплантов на питательной среде [8].
Большинство работ по регенерации Prunus выполнено на семенном материале или с использованием соматических тканей подвойных форм и межвидовых гибридов, имеющих более высокий, по сравнению с сортами, морфогенетический потенциал. В то же время имеются лишь отдельные сообщения об успешной регенерации сортовых растений сливы домашней. F. Cossio, G. Bassi [10] добились регенерации сорта Bluefre. Получены регенераты из листовых высечек бельгийского сорта Altesse simple, болгарских сортов Kjustendilska sliva и Stanley [4, 5].
Целью настоящих исследований являлась разработка эффективных методов культивирования in vitro и регенерации из соматических тканей культурных сортов сливы домашней (Primus domestica) средней полосы России.
В опыты были включены сорта сливы домашней (Prunus domestica). Ренклод Харитоновой, Венгерка итальянская, Ода, Синеокая, Радость, Евразия 21, Заречная ранняя, Этюд, Стартовая.
Для культивирования сливы in vitro использовали минеральную основу питательных сред Мурасиге-Скуга [II] и Кворина- Лепорье [12], дополненную мезоинозитолом - 100 мг/л, гидролизатом казеина - 100 мг/л, сахарозой - 30 г/л, агаром - 6-7 г/л. На этапах введения и микроразмножения сливы использовали 6-БАП - 1-3 мг/л, ГК - 0,5-2,0 мг/л, НУК - 0,1-0,3 мг/л или ИМК - 0,1-0,3 мг/л и комплекс витаминов. На этапе укоренения микрочеренков концентрацию макросолей и сахарозы снижали вдвое. В качестве индуктора ризогенеза применяли ИМК. Ауксин вводили в среду (0,2-2,0 мг/л) или замачивали микрочеренки в растворе ИМК (50 мг/л в течение 18 часов) с последующей высадкой их на среду без регуляторов роста. рН питательной среды устанавливали в пределах 5,6-5,8. Растения культивировали при t=26±2 °С и 16-часовом световом дне.
В качестве источника растительного материала в опытах по индукции морфогенеза из соматических тканей использовали листья культивируемых in vitro побегов сливы. Каждый лист нарезали поперечно центральной жилке на 2-3 экспланта площадью 0,5-1,0 см2. Культивировали высечки листовых пластинок в виде равнобедренного треугольника с черешками и средние части листовых пластинок. В ряде опытов по регенерации эксплантами, кроме того, служили черешки листьев (0,3-0,5 см) и сегменты стебля (0,4-0,7 см) или корня (0,7-1,5 см) стерильных растений.
Культивирование эксплантов проводили па питательной среде MS. В опытах по изучению влияния источника углеродного питания на эффективность регенерации использовали сахарозу, лактозу, глюкозу, фруктозу, мальтозу в концентрации 10-40 г/л. В качестве основных регуляторов роста использовали вещества с цитокининовой активностью: 6-БАП, тидиазурон (ТДЗ), зеатин, 2ip в концентрации 1,65-5 мг/л и ауксины: НУК, ИМК, 2,4-D, ИУК в концентрации 0,1- 0,5 мг/л в различных сочетаниях. Регуляторы роста и витамины фирмы «Serva», Германия.
Регенерировавшие побеги срезали с листовых пластинок и доращивали по стандартной схеме клонального микроразмножения сливы.
В результате исследований установлено, что наиболее благоприятным периодом для введения в культуру in vitro сливы является фаза выхода растений из состояния покоя (февраль-март). Стерилизация 0,3 % раствором нитрата ртути в течение 30 минут черенков длиной 0,7-1,3 см с непроросшими почками не обеспечила достаточной эффективности введения: 76-92 % растительного материала оказалось инфицировано грибами и бактериями. В случае использования меристематических верхушек размером 0,2-0,4 см, изолированных из развивающихся почек, отсутствие покровных тканей и небольшие размеры экспланта обеспечили достаточно эффективную стерилизацию: было заражено только 9-16% растительного материала каждого сорта. Однако нитрат ртути был токсичным и для растительных тканей, вызвав гибель от 1/3 до 1/2 эксплантов.
Клональное микроразмножение сливы осуществляли по традиционной модели пролиферации пазушных побегов. Введение в питательную среду 6-БАП вело к снятию апикального доминирования и стимулировало образование побегов из пазушных почек. Использование модифицированной питательной среды Кворина-Лепорье с соотношением регуляторов роста 1-2 мг/л 6-БАГТ, 0,5-1 мг/л ГК, 0,2 мг/л НУК в нулевом (введение в культуру) и первом пассажах, позволило получить к концу первого пассажа жизнеспособные конгломераты из 3-6 почек и побегов всех сортов.
Коэффициент размножения сливы зависел от особенностей сорта и от концентрации цитокинина в питательной среде. Наиболее эффективна в фазе пролиферации почек и побегов концентрация 6-БАП в питательной среде 1-2 мг/л в сочетании с ГК - 1-2 мг/л, НУК или ИМК - 0,2 мг/л. При данных концентрациях гормонов изучаемые сорта имели средние коэффициенты размножения за пассаж в пределах 3,6-6,5. Наличие ГК в среде обеспечивало образование достаточного количества побегов длиной свыше 1,5 см, пригодных для укоренения, что исключало промежуточный этап культивирования на средах с пониженной концентрацией цитокинина (0,01-0,25 мг/л), рекомендуемый рядом авторов в пассаже, предшествующем укоренению [13, 14].
Использование цитокинина в концентрации 3 мг/л повышало коэффициент размножения. Однако при этом, как правило, формировались побеги с укороченными междоузлиями и проросшими боковыми почками, длиной не более 1,5 см. Эти побеги дополнительно доращивали.
Наши исследования показали, что эффективность укоренения сливы в значительной мере определяется генотипом. Данные по укореняемости побегов различных сортов сливы на разбавленной среде Кворина-Лепорье при концентрации ИМК в среде 1 мг/л представлены в таблице. Использование разбавленной среды Мурасиге-Скуга не вело к существенному изменению частоты ризогенеза исследуемых сортов. В результате исследований выделены легко укореняемые сор- га сливы, такие как Евразия 21, Этюд, Ода, которые образовали и большее число корней на укорененное растение. Для этих сортов концентрацию ИМК в среде укоренения снизили до 0,5 мг/л.
Таблица
Эффективность укоренения различных сортов сливы
на среде 1/2 QL при концентрации ИМК 1 мг/л
Сорт | Всего побегов, шт. | Укоренилось побегов, % | Число корней на укорененное растение, шт. |
Евразия 21 | 164 | 96,9±1,4 | 4,5±0,6 |
Этюд | 139 | 95,7±1,7 | 4,4±0,4 |
Ода | 86 | 91,9±2,9 | 4,5±0,3 |
Радость | 83 | 84,3±4,0 | 3,6±0,2 |
Заречная ранняя | 64 | 78,1 ±5,2 | 3,2±0,4 |
Венгерка итальянская | 59 | 72,9±5,8 | 3,2±0,3 |
Ренклод Харитоновой | 87 | 57,5±5,3 | 3,1 ±0.4 |
Стартовая | 135 | 56,3±4,3 | 2,0±0,2 |
Синеокая | 130 | 56,9±4,3 | 3,0±0,3 |
Способ введения ИМК практически не влиял на частоту укоренения легко укореняющихся сортов сливы, но снижал эффективность Укоренения трудно укореняющихся генотипов. Так, при замачивании микрочеренков в растворе ИМК (50 мг/л в течение 18 часов) эффективность укоренения сортов Евразия 21 и Этюд была 97-100%, как и при введении ауксина в среду в концентрации 0,5-1,0 мг/л. Тогда как через 6 недель культивирования укоренилось только 19,0% микрочеренков сорта Синеокая при замачивании их в растворе ауксина и 53,2 % микрочеренков при введении ИМК в среду.
Широкий спектр физиологической активности регуляторов роста и достигнутые с их помощью успехи в реализации морфогенетического потенциала растительных клеток позволяют считать регуляторы роста одним из основных факторов управления морфогенезом in vitro. В последние десятилетия при регенерации из зародышевых и соматических тканей Prunus наиболее успешно применяли тидиазурон [1-8].
В наших исследованиях использование ТДЗ и ИМК в наиболее часто употребляемых при регенерации Prunus концентрациях (1,65- 2,8 мг/л ТДЗ + 0,1-0,5 ИМК) не имело должного эффекта. Частота регенерации побегов из листовых тканей исследуемых сортов сливы не превышала 2-12 %. Положительный эффект дало увеличение концентрации ТДЗ до 4-5 мг/л. Оценивали эффективность применения цитокинина ряда дифенилмочевины по сравнению с производными аденина.
По ряду сортов не показано преимущество использования ТДЗ по сравнению с 6-БАП. Общей закономерностью, характерной для всех сортов, является увеличение частоты регенерации корней на средах с ТДЗ по сравнению со средами, содержащими в качестве цитокинина 6- БАП. Наблюдали существенные сортовые различия по реакции на гормональные факторы среды (рис. 1).
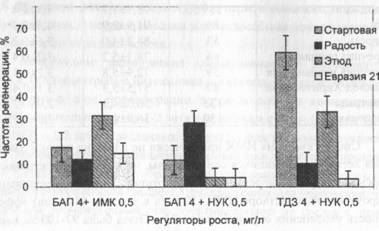
Рис. 1. Регенерация адвентивных побегов из листовых эксплантов четырех сортов сливы домашней
Для сортов Стартовая и Евразия 21 эффективным явилось сочетание ТДЗ и НУК, тогда как использование ТДЗ в сочетании с ИМК при тех же концентрациях не эффективно. Сорт Этюд лучше всего регенерировал на средах, содержащих 4-5 мг/л БАП и 0,2 или 0,5 мг/л ИМК. Для этого сорта положительный эффект дало добавление в среду 0,5 мг/л ГК (46,1 % регенерации побегов). Сорта Радость и Синеокая без существенной разницы регенерируют как на средах, содержащих ТДЗ, так и на средах с 6-БАП. Частота регенерации побегов достигала 30 %. Ни одна из испытанных комбинаций гормонов не является достаточно эффективной для индукции адвентивных побегов сор та Ода.
Как показали результаты наших исследований, регенерация побегов происходит только при количественном преобладании цитокинина над ауксином в соотношении от 8:1 до 25:1. Наивысшая частота регенерации побегов получена на средах, содержащих в качестве вещества с цитокининовой активностью БАП или ТДЗ в концентрации 5 мг/л. Применение 2ip оказалось наименее действенным при культивировании листовых тканей сливы. Еще в большей степени частота регенерации зависела от типа вводимого в среду ауксина.
Анализ литературных данных показывает, что при регенерации косточковых почти всегда использовали ИМК или НУК. По нашим данным, наиболее удачными из ранее испытываемых при регенерации сливы, являются комбинации БАП+ИМК, БАП+НУК, ТДЗ+НУК (до 50-60 % регенерации побегов сорта Этюд и сорта Стартовая). Однако замена этих ауксинов на 2,4-Д или ИУК позволила существенно повысить частоту регенерации для ряда сортов сливы (до 70-85 % регенерации побегов). Кроме того, на средах с этими ауксинами не наблюдали регенерации корней, которая зачастую имела место на средах с ИМК или НУК.
Изучали влияние на индукцию морфогенеза ряда других факторов, в частности, источника углеродного питания в среде. Оценивали влияние на процесс регенерации пяти углеводов - сахарозы, глюкозы, мальтозы, фруктозы, лактозы. Наиболее активно стимулировали
образование и рост каллуса и, что более существенно, дифференциацию адвентивных почек и побегов, глюкоза и сахароза.
В наших исследованиях наиболее интенсивно закладка мери- стематических очагов происходила при концентрации углевода в среде 30 и 40 г/л. Например, на средах, содержащих углевод в количестве 30 и 40 г/л, соответственно на глюкозе получено 36,2 % и 39,2 % регенерации побегов сорта Этюд (среда MS: БАП 5+ГК 0,5+ИМК 0,2 мг/л) и 15,7 % и 25,5 % на сахарозе. Однако на средах, содержащих сахарозу, регенеранты отличались лучшим развитием и отсутствием побегов с морфологическими изменениями. Для оптимального развития побегов полученные на средах с глюкозой морфогенные образования пересаживали на среды с сахарозой.
Оценивали морфогенетический потенциал различных частей вегетативных органов растения - листьев, стебля, корней. При использовании черешков и отрезков стебля регенерация проходила через стадию каллусообразования с закладкой меристематических очагов в первичном каллусе и дальнейшем их развитии в почки и побеги. Но каллус образовывался не во всех случаях, особенно слабым каллу- сообразование было на отрезках стебля. При культивировании отрезков корней каллусообразование происходило достаточно интенсивно, но образования почек не наблюдали.
По нашим данным, листовые ткани сливы обладают более высоким морфогенетическим потенциалом по сравнению с тканями стебля и корня. Морфогенетический потенциал неодинаков и по длине листа, а именно, он увеличивается к основанию листа, то есть к растущей его части. По данным ряда авторов, на P.canescens [15], а также на сеянцах абрикоса и сливы [6] регенерация в основном происходит на черешках листьев и в области главной жилки дистальной части листа. Наши данные по изучению разных сортов сливы домашней подтверждают эти наблюдения. При этом, если использовать листовые ткани одной физиологической зрелости, то не столь существенно - с укорененных или неукорененных побегов они срезаны. Данный фактор является второстепенным по отношению к таким определяющим моментам, как генотип растения, состав среды, возраст экспланта.
Ориентация эксплантов на среде имела существенное влияние на каллусообразование и органогенез в культуре высечек листьев сливы домашней. По нашим данным, экспланты следует помещать на среду адаксиальной (верхней) стороной, поскольку при абаксиальной ориентации процесс каллусообразования сильно угнетен, и листовые ткани быстро некротизируют.
Как показали результаты наших исследований, модель и эффективность регенерации из соматических тканей сливы домашней определяется рядом факторов, основными из которых являются генотип растения, гормональный и углеводный состав питательной среды, тип экспланта.
Заключительным этапом культивирования in vitro является адаптация полученных растений к естественным условиям произрастания. Адаптацию укорененных in vitro растений можно проводить как в специально оборудованных теплицах с регулируемой температурой и влажностью воздуха круглогодично, так и высаживая их в весенне-летний период непосредственно в нестерильный грунт под пленочные укрытия при наличии воздушно-капельного орошения. В зависимости от сорта адаптировано к нестерильным условиям от 51,7 до 95,7 % растений сливы, полученных in vitro.
Литература
- Mante S., Scorza R., Cordts J.M. Plant regeneration from cotyledons of Prunus persica, Prunus domestica and Prunus cerasus // Plant Cell Tiss.Org.Cult. - 1989. - V. 19.-P. 1-11.
- Mante S„ Morgens P.H., Scorza R. et al. Agrobacterium-mediated transformation of plum (Prunus domestica L.) hypocotyl slices and regeneration of transgenic plants // Biotechnology. - 1991. - V. 9. - P. 853-857.
- Gonzalez Padilla I.M., Webb K., Scorza R. Early antibiotic selection and efficient rooting and acclimatization improve the production of transgenic plum plants (.Prunus domestica L.)ll Plant Cell Rep. - V. 22. - P. 38-45.
- Yancheva S.D., Gercheva P. Preliminary stadies on regeneration capacity of plum (Prunus domestica L.) somatic tissues in vitro // Biotechnol. and Biotechnol. - 1993.-V. 7, № 1. - P. 49-52.
- Yancheva S.D., Preliminary stadies on regeneration and transformation of plum (Prunus domestica L.) //Acta. Hort. - 1994. - V. 359. - P. 159-163.
- Escalettes V., Dosba F. In vitro adventitious shoot regeneration from leaves of Prunus spp. II Plant Science. - 1993. - V. 90. - P. 201-209.
- Hammatt N., Grant N.J. Apparent rejuvenation of mature wild cherry (Prunus avium L.) during mieropropagation // J. Plant.Physiol. - 1993. - V. 141,№3.-P. 341-346.
- Perez-Tornero D., Burgos L. Adventitious shoot regeneration from in vitro cultured leaves of apricot // Acta. Hort. - 2000. - V. 538. - P. 659-661.
- Declerck V., Korban S. S. Influence of growth regulators and carbon sources on callus induction, growth and morfogenesis from leaf tissues of peach (Prunus per- sica L. Batsch). // J. Hort. Sci. - 1996. - V. 71. - P. 49-55.
- Cossio F., Bassi G. Ricerche sulla organogenesi di alcuni Prunus'. rigenerazione "in vitro" cultivar "Bluefre" // Riv. Fruttic. Ortofloric. - 1991. - V. 53, № 3. - P. 77-81.
- Murashige Т., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiol. Plant. - 1962. - V. 15, № 13. - P. 473-497.
- Quoirin M., Lepoivre P. Improved medium for in vitro culture of Prunus sp. // /Acta Hortic. - 1977. - V. 78. - P. 437-442.
- Туровская Н.И. Регулирование процесса ризогенеза при микроразмножении яблони // Микроразмножение и оздоровление растений в промышленном плодоводстве и цветоводстве: Сб. науч. тр. / ВНИИС им. И.В. Мичурина. - Мичуринск, 1989.-С. 8-13.
- Высоцкий В.А. Клональное микроразмножение плодовых растений и декоративных кустарников // Микроразмножение и оздоровление растений в промышленном плодоводстве и цветоводстве: Сб. науч. тр. ВНИИС им. 31.В. Мичурина. - Мичуринск, 1989. - С. 3-8.
- Antor.elli М., Druart P. The use of a brief 2,4-D treatment to induce leaf regeneration of Prunus canescens // Bois. Acta Hortic. - 1990. - V. 280. - P. 45-50.

