УДК 634.8:577.12
ВЛИЯНИЕ ИНТЕНСИВНОСТИ, СПЕКТРАЛЬНОГО СОСТАВА ОСВЕЩЕНИЯ И КАЛИЙНОГО ЛИГНОГУМАТА НА РЕГЕНЕРАЦИОННУЮ СПОСОБНОСТЬ ВИНОГРАДА IN VITRO
А.А. Соболев, А.Н. Ребров, Н.П. Дорошенко
ГНУ Всероссийский НИИ виноградарства и виноделия им. Я.И. Потапенко,
г. Новочеркасск
Изучено влияние интенсивности и качества освещения при добавлении в питательную среду калийного лигногумата марки AM в процессе культивирования винограда сорта Фиолетовый ранний на этапе микрочеренкования побегов. Установлено, что данные факторы в испытуемых дозах не оказывают влияния на ризогенез, но существенно влияют на надземную часть растений.
Важным фактором регенерации культивируемых тканей является поддержание в них оптимального уровня метаболических процессов. При этом одним из главных источников энергии выступает световая, которая в процессе фотосинтеза превращается в энергию химических связей органических веществ. Благодаря этому преобразованию происходит синтез полимерных соединений, поглощение воды и минеральных веществ, их переработка и транспорт, осуществляются разные виды движения, в том числе и рост. Тем не менее, растительная биомасса способна аккумулировать и эффективно использовать лишь небольшой процент приходящей световой энергии. Кроме того, значительная ее доля расходуется на фотодыхание, а также на теплообмен, флуоресценцию и фотосинтез [1]. Несмотря на то, что радикальных путей снижения затрат ассимилятов пока не найдено, есть данные, что потери сухого вещества биомассы в результате дыхания можно снизить при помощи регуляторов роста [2]. Следует отметить, что расходная часть энергетического баланса существенно зависит от условий культивирования, и в частности, от той же освещенности, содержания в среде гормонов и питательных веществ.
В последнее время все более возрастает интерес к использованию комплексных биоорганических и биоминеральных удобрений, ориентированных на повышение биологического потенциала и продуктивности сельскохозяйственных культур [3]. Одними из таких веществ является гуминовые, полученные в результате утилизации (гумификации) растительного сырья. Помимо прочих преимуществ веществ данной группы перед их синтетическими аналогами, они способны накапливать долгосрочные запасы всех элементов питания (в том числе и углеводов) в различных средах; изменять проницаемость клеточных мембран, повышать активность ферментов, стимулировать процессы дыхания, синтеза белков и углеводов; увеличивать содержание хлорофилла и интенсивность фотосинтеза [4]. Все это делает привлекательным использование препаратов данной группы в биотехнологиях высших растений, особенно учитывая то, что гуминовые кислоты хелатируют ионы кальция и других двувалентных элементов, делают более доступными витамины, аминокислоты и фитогормоны благодаря образованию сложноорганических соединений [5]. Производственные испытания препарата из серии лигногумат при получении меристемных растений более чем 10 видов культур позволили выявить ускорение процессов развития меристем в 1,5-2,0 раза и ризогенеза на 20-30 %; увеличения на 50 % количества корней; повышения уровня укоренения мериклонов в почве до 85-90 %.
Исходя из вышеперечисленного, нами было принято решение: изучить возможность повышения регенерационного потенциала эксплантов винограда при помощи коррекции интенсивности освещения, его спектрального состава и добавления в состав питательной среды лигногумата для более эффективного использования лучевой энергии. Ранее мы уже сообщали о некоторых аспектах культивирования винограда in vitro при освещении светом различного спектрального состава низкой интенсивности [6, 7]. Тем не менее, спектральная избирательность изолированных тканей винограда остается слабо изученной, из чего вытекает необходимость продолжения данных исследований.
Исследования проводили на этапе микрочеренкования побегов сорта Фиолетовый ранний на жидкой питательной среде MS в модификации П.Я. Голодриги, В.А. Зленко и др. [8] с добавлением 0,1 мг/л (3-ИУК при температуре воздуха 24-27 °С и относительной влажности воздуха > 70 %. Испытуемое освещение - экспериментальными фотосинтетическими люминесцентными лампами ЛФ 40-4 (оранжевая область спектра, = 611 нм) и ЛФ 40-5 (преобладание лучей в синей области ФАР, « 450 нм) интенсивностью 2*40 и 3x40 Вт; контроль - люминесцентные лампы дневного света ЛД-40 той же интенсивности.
В качестве источника гуминовых веществ использован калийный лигногумат марки AM в концентрациях 0,005; 0,010 и 0,015 г/л. Общее содержание солей гуминовых веществ в сухом веществе данного препарата составляет более 90 %, из них 60-62 % - органические вещества. Массовая доля высокомолекулярных гуминовых кислот - 70-85 % от органики; 15-30 % - низкомолекулярные, в том числе и фульвокислоты. Содержание металлов, являющихся катионами солей гуминовых веществ: калий - 20 %, кальций - 0,5 %; микроэлементы. Препарат не изменяет рН среды, не выпадает в осадок, термо- и фотостабилен.*
*Изготовитель НПО «Реализация экологических технологий».
На каждый вариант опыта (интенсивность освещения + качество света + концентрация лигногумата) было высажено по 10 эксплантов (одноглазковый микрочеренок с прилежащей листовой пластинкой) в 2-3 повторностях; всего в опыте 520 шт. В качестве контрольных выбраны варианты опыта БС (белый свет, лампы ЛД-40) интенсивностью 2 и 3x40 Вт + 0 г/л лигногумата. Статистическая обработка данных проведена по методикам Т. Литгла, Ф. Хиллза [9], Э.М. Менчера, А.Я. Земшмана [10] с использованием программы Stadia при 95 % уровне доверительной вероятности.
Поскольку наряду с последовательной индукцией определенных генетических программ для регенерации наиболее важна морфологическая ориентация в пространстве, то в качестве основных изучаемых показателей были выбраны характеристики развития ризогенной зоны и надземной части растений-регенерантов. Анализ результатов, полученных после 60 дней культивирования, позволяет говорить о следующем.
Максимальное значимое увеличение ризогенной зоны (количество корней х среднюю длину одного корня) по сравнению с контролем отмечено при 0,015 г/л калийного лигногумата на оранжевом и синем освещении интенсивностью 2x40 Вт (29,5 ± 3,8; 25,8 ± 3,4; контроль - 13,3 ± 0,9 см). Достоверного снижения данного показателя по сравнению с контролем не наблюдалось. Однако проведенный многофакторный дисперсионный анализ показал отсутствие влияния организованных факторов и их взаимодействия как на количество, так и на длину образовавшихся корней.
На изменчивость растений по высоте (таблица) большее влияние оказало качество света, нежели лигногумат. При интенсивности лучевого потока 2Х40 Вт наблюдалось их взаимодействие, которое объясняло 25 % вариабельности результативного признака.
Таблица
Влияние качества, интенсивности освещения и концентрации
лигногумата на высоту растений, см
Качество освещения | Интенсивность освещения, Вт | Концентрация лигногумата, г/л | |||
0,000 | 0,005 | 0,010 | 0,015 | ||
ОС | 2x40 | 6,3 ± 1,1 | 6,9 ± 1,1 | 10,5 ±0,8* | 10,2 ±0,8* |
3x40 | 8,3 ± 0,9 | 8,0 ± 0,7 | 7,0 ± 0,9 | 7,4 ± 1,1 | |
СС | 2x40 | 5,1 ±0,3* | 4,4 ± 0,6* | 5,4 ± 0,7 | 6,6 ± 0,4 |
3x40 | 3,9 ± 0,4** | 4,8 ±0,3** | 3,8 ±0,4** | 5,4 ±0,6** | |
БС | 2x40 | 6,8 ± 0,3 | 7,7 ± 0,4 | 7,2 ± 0,3 | 6,5 ± 0,5 |
3x40 | 9,0 ± 0,7 | 5,1 ± 1,0** | 6,4 ± 1,1 | 6,0 ±0,8** | |
* Различия между вариантом опыта и контролем (БС - 2 х 40 Вт - 0,0 г/л) существенны с вероятностью > 95 %.
** Различия между вариантом опыта и контролем (БС - 3*40 Вг- 0,0 г/л) существенны с вероятностью > 95 %.
Максимальное увеличение высоты растений характерно для вариантов опыта с оранжевым освещением 2x40 Вт при 0,010 и 0,015 г/л лигногумата. Синий свет изучаемой интенсивности, независимо от концентрации в питательной среде лигногумата, ингибировал рост побегов в высоту. То же суждение характерно и для белого света интенсивностью 3*40 Вт.
Темпы роста растений оказали влияние и на длину междоузлий: при более сильном росте (оранжевое излучение) они были на 20-40 % длиннее контрольных; при замедленном (синий свег и белый свет 3 х40 Вт + 0,015 г/л) - настолько же короче.
В отличие от качества освещения, концентрация лигногумата оказала влияние и на количество образовавшихся листьев (рисунок 1); влияние взаимодействие факторов не повлияло на данный показатель.
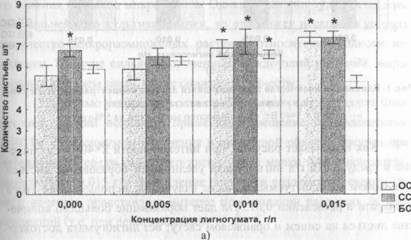
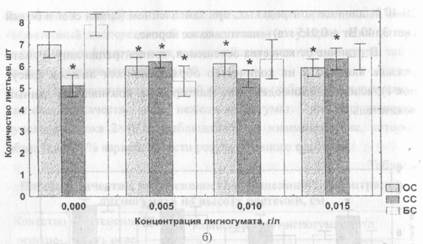
Рис. 1. Влияние на количество образовавшихся листьев концентрации лигногумата, качества и интенсивности освещения:
а - 2x40, б -3*40 Вт; «*» - индикатор значимости на 5 % уровне
Как показывает рисунок, при интенсивности 2 x 40 Вт добавление в среду 0,010 г/л лигногумата увеличивает образование листьев при любом из испытуемых качеств излучения; использование этого препарата в разведении 0,015 г/л дает образование большего количества листьев на синем и оранжевом свету; без лигногумата достоверное увеличение отмечается только в варианте с лучевым потоком, максимум которого находится в синей области спектра. Световой поток интенсивностью 3 х40 В г различного качества на фоне применения лигногумата тормозит образование новых листьев.
ВЫВОДЫ:
1. В исследуемых дозах организованные факторы не оказали существенного воздействия на ризогенез микрочеренков винограда сорта Фиолетовый ранний, но оказали влияние на развитие надземной части. На высоту растений большее влияние имело качество освещения и меньшее концентрация лигногумата. Их синергетическое действие при интенсивности излучения 2 х40 Вт на 25 % обусловило достоверное увеличение высоты растений в 1,5 раза при добавлении в среду 0,010 и 0,015 г/л лигногумата. На образование новых листьев более других факторов повлиял лигногумат.
- Освещение в оранжевой области спектра интенсивностью 2*40 Вт в сочетании с лигногуматом (0,010 и 0,015 г/л), помимо увеличения высоты растений, увеличивает также и длину их междоузлий. В случае, когда после этапа микрочеренкования побегов, сохраняющих апикальное доминирование, растения будут адаптированы к нестерильным условиям среды, этот факт не оказывает существенного влияния на выход микроклонов. Однако если они будут оставлены для дальнейшего культивирования, то это может несколько снизить количество микроразмноженых растений относительно одного исходного. Наличие сильно укороченных междоузлий растений, выращенных на синем свету, также снижает их качество.
- С целью ускорения роста пробирочных растений сорта Фиолетовый ранний возможно применять освещение интенсивностью 2x40 Вт с максимумом излучения в оранжевой области спектра при добавлении в среду калийного лигногумата марки AM в концентрациях 0,010 и 0,015 г/л. Замедление роста при воздействии светом синего качества представляет интерес при создании растущих in vitro коллекций (т.е. при депонировании).
Литература
- Жученко А.А. Адаптивный потенциал культурных растений (эколого-генетические основы). - Кишинев: ШТИИНЦА, 1988. - 767 с.
- Основы сельскохозяйственной биотехнологии / Г.С. Муромцев, Р.Г. Бутенко, Т.Н. Тихоненко, М.И. Прокофьев. - М.: Агропромиздат, 1990. - С. 35-36.
- Биологизация АПК - путь к устойчивому развитию / А.Е. Казаков, А.Ю. Борисов, В.К. Чеботарь // Интернет-журнал «Коммерческая биотехнология» [Электронный ресурс]. - Режим доступа: http://www.cbio.ru/v5/modules/news/article.php?storyid=206.
- Особенности промышленного производства и сельскохозяйственного использования новых высокоэффективных органических и органо-минеральных удобрений на основе новых технологий утилизации растительного сырья / Р.Г. Иванова, О.А. Гладков, И.В. Соколова // НПО «Реализация экологических технологий» [Электронный ресурс]. - Режим доступа: http://www.huraate.spb.ru/gumat.php.
- Плащев В.М. Использование лигногумата в культуре изолированных меристемных тканей высших растений // НПО «Реализация экологических технологий» [Электронный ресурс]. - Режим доступа: http://www.humate.spb.nj/files/articles/plashev.piJf.
- Соболев А.А., Дорошенко Н.П. Световая биотехнология в культуре изолированных тканей винограда // Виноделие и виноградарство. - 2004. - № 6. - С. 27-29.
- Соболев Л.А. Обоснование приемов световой биотехнологии при клональном микроразмножении винограда: Автореф. дис. ... канд биол. наук. - Краснодар, 2004. - 25 с.
- Технология ускоренного размножения сортов винограда с применением культуры изолированной ткани / П.Я. Голодрига, В.А. Зленко и др. // Сельскохозяйственная биология. - 1985. - № 3. - С. 62-66.
- Литтл Т, Хиллз Ф. Сельскохозяйственное опытное дело. Планирование и анализ. - М.: Колос, 1981. - 320 с.
- 10. Менчер А.Я , Земшман Э.М. Основы планирования эксперимента с элементами математической статистики в исследованиях по виноградарству. - Кишинев: ШТИИНЦА, 1986. - 237 с.
По материалам конференции: Современные достижения биотехнологии в виноградарстве и других отраслях сельского хозяйства, Новочеркасск, 29-30 июня 2005 г. / ГНУ ВНИИВиВ им. Я.И. Потапенко.

