М. Г. Бежуашвили, гл. научный сотрудник отдела виноделия и биохимии,
Н.Г. Вепхишвили, докторант,
Т.Д. Кобаидзе, с.н.с. отдела виноделия и биохимии
Институт садоводства, виноградарства и виноделия Грузии
ИДЕНТИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ БИОЛОГИЧЕСКИ АКТИВНОГО ε-ВИНИФИРИНА В ВИНОГРАДЕ И ВИНОМАТЕРИАЛАХ СОРТОВ САПЕРАВИ И КАБЕРНЕ-СОВИНЬОН
Исследованы кожицы винограда красных технических сортов, распространяющихся в восточной Грузии — Саперави и Каберне-Совиньон; а также приготовленные из этих сортов самоосветлённые виноматериалы для столовых сухих вин. Из кожицы и виноматериалов выделены стильбенсодержащие фракции и в них идентифицирован димер ресвератрола ε-виниферин на основе разных характеризующих данных по сравнению индивидуального ε-виниферина. Концентрация ε-виниферина определена по ВЭЖХ; в виноматериале Саперави составляет 0,98 мг/л, а Каберне-Совиньон 0,40 мг/л. Результаты представляют собой теоретические основы для дальнейшего исследования биологически активности и лечебно-питательной ценности грузинских красных вин.
С выявлением «французского парадокса» исследование лечебно-питательного свойства красных вин, стало актуальным вопросом многих ученых и в настоящее время функциональность красных вин подтверждена многочисленными опытами [1-7]. Польза красных вин для здоровья человека, в основном обусловлена ими фенольными веществами, характеризующимися высокой биологической активности [8-12]. Фенольный комплекс красных сортов винограда и вин представлен богатым спектром антоцианов, проантоцианов, флавонолов, катехинов, фенолокислот, стильбенов [13-15]. Среди них важное место занимают соединения стильбеновых групп, так как они обладают высокой биологической активностью и играют значительную роль при формировании лечебнопитательного свойства красных вин. Мономерный стильбен-ресвератрол в красных винах представлен в виде транс- и цис- изомерных форм, а также их соответственными глюкозидами - пицейдами. Это подтверждено исследованиями красных и розовых вин в разных странах [16-20].
Ресвератрол характеризуется разной биологической активностью. Для виноградной лозы он является фитоалексином [21]; обладает: антиоксидантным, антиканцерогенным, антибактериальным, антиплателитическим, антиатеросклерозным свойством, лечебно-профилактическим воздействием на заболевания сердечно-сосудистой системы [22-26].
В красных винах идентифицированы производные ресвератрола: в частности его димерные формы в виде дельта- и ε-виниферина, тримерный α-виниферин и тетрамерный ресвератрол. Из представителей стильбеновых групп в красных винах также содержатся паллидол, астрингин, пицеатанол [27-30]. В бразильском красном вине сорта Мерло дельта-виниферин содержится в количестве 10 мг/л [31]. В южноафриканских красных винах транс-ε-виниферин содержится в следующих количествах (мг/л): Мерло 1,2; Каберне-Совиньон - 0,69; Ксар - 0,49; Amjad - 0,2; Не фиксируется в винах, приготовленных из сортов Мускат, Sidi-Brahim, Terrale, Guerrouane, Gris d’Algerie [32].
Многочисленные данные указывают на биологическую активность виниферина: природный виниферин обладает антивоспалительным свойством, обусловленного ингибированием PDE4 [33]; (+)-виниферин, выделенный из Sophora mooracroftiana, оказывает ингибирующее действие при окислении липидов супероксидным анионом [34]. Виниферин, ресвератрол и полифенол, выделенные из побегов виноградной лозы, обладают окислительным и апоптическим эффектом на хронические лимфоциды лейкемии [35]. У виниферина, выделенного из красного вина, оказался более сильный ингибирующий эффект к микросомам печени человека по сравнению с резвератролом [36]. Антиоксидантная активность транс- ε-виниферина, выделенного из виноградной лозы, подтверждена в сравнении ресвератрола и синтетического 4-гидроксистильбена, 4,4-дигидроксистильбена, 3,5-дигидроксистильбена и триметилрезвератрола [37]; ε-виниферин является фитоалексином [38, 39]; Ингибирующий эффект ε-виниферина выявлен на цитохроме Р450 [40].
Исследование содержания стильбенов в винограде и вине мы начали с 1991 года идентификацией транс-ресвератрола в однолетних побегах (обрезках) виноградной лозы [41]. Продолжая эту работу, ещё идентифицированы ε-виниферин и 2 тетрамеры ресвератрола [42, 43]. Транс-ресвератрол определён в кожице винограда красных технических сортов и вин из этих сортов: Саперави, Каберне-Совиньон, Оцханури Сапере и Тавквери [44, 45]. Установлена динамика накопления транс-ресвератрола при приготовлении красных вин.
Выявлено стимулирующее воздействие транс-ресвератрола на винных дрожжах при алкогольном брожении [46] и антагонистическое влияние на микроорганизмы Agr.tumefaciens, вызывающее рак виноградной лозы [47]. В опытах «in vitro» определена антиоксидантная активность транс-ресвератрола, ε-виниферина и тетрамерных стильбенов, в качестве ингибиторов образования малондиальдегида в сыворотке крови человека [48].
Продолжая исследование стильбеновых веществ в грузинских красных винах в связи их биологической активности и лечебно-питательных свойств, мы задались целью идентифицировать и определить ε- виниферин в виноградах и винах красных технических сортов Саперави и Каберне-Совиньон и винах из этих сортов.
Объекты и методы исследования.
Объектами исследования служили: кожица винограда красных технических сортов Саперави и Каберне-Совиньон; самоосветлённые виноматериалы для приготовления столовых сухих красных вин, полученные из вышеуказанных сортов. Образцы были взяты в Кахетии (восточная Грузия) из урожая 2008-го года.
Стильбенсодержащие суммарные препараты из кожицы и виноматериалов получили путём их экстракции этилацетатом. Измельченные и воздушносухие кожицы исчерпывающее извлекали этилацетатом путём ступенчатой экстракции (длительность каждого 30 мин.) в горячих условиях. Этилацетатные фракции соединяли и концентрировали на ротационном испарителе, с получением исследуемого суммарного экстракта.
Виноматериалы в количестве 1,0 л концентрировали на ротационном испарителе до 200 мл, затем переносили в делительной воронке и 3 раза извлекали этилацетатом при комнатной температуре. Этилацетатные фракции соединяли и концентрировали с получением исследуемого суммарного экстракта.
С целью выделения стильбенсодержащих суммарных препаратов, полученные экстракты фракционировали колоночной хроматографией на адсорбенте «Сефадекс G-22», элюированием смесью растворителей метанол: вода (3:2) [27]. Элюат концентрировали на ротационном испарителе и исследовали.
Качественный анализ стильбенсодержащего суммарного препарата проводили тонкослойной хроматографией на пластинках силуфола (20 см х 20 см) в системе растворителей хлороформ: метанол (80:20). Хроматограммы просматривали как под ультрафиолетовым облучением, так и проявляли диазотированной сульфаниловой кислотой. Индивидуальный ε-виниферин (метчик для контроля) выделяли из однолетных побегов (обрезков) виноградной лозы, ε-виниферин из исследуемых образцов в индивидуальном виде выделяли препаративной хроматографией и снимали их ультрафиолетовые и инфракрасные спектры.
Высокоэффективная жидкостная хроматография (ВЭЖХ). Определение ε-виниферина проводили в центральной лаборатории нашего института в следующих условиях: высокоэффективный жидкостной хроматограф фирмы «Varian»; модуль колонки - Prostar 500; переносный модуль растворителей - Prostar 210; детектор - ультрафиолетовый/видимый спектр - Uv/Vis spectrometer Prostar 325; колонка - Microsorb 100 С 18; 250x4,6 Lxld (mm); 5pm - Particle Size; условия градиентного режима: растворитель А - 0,025%-ый водный раствор TFA (трифторуксусная кислота); растворитель B-ACN/ А, 80/20 (v/v);
0-35 min 20-50% В;
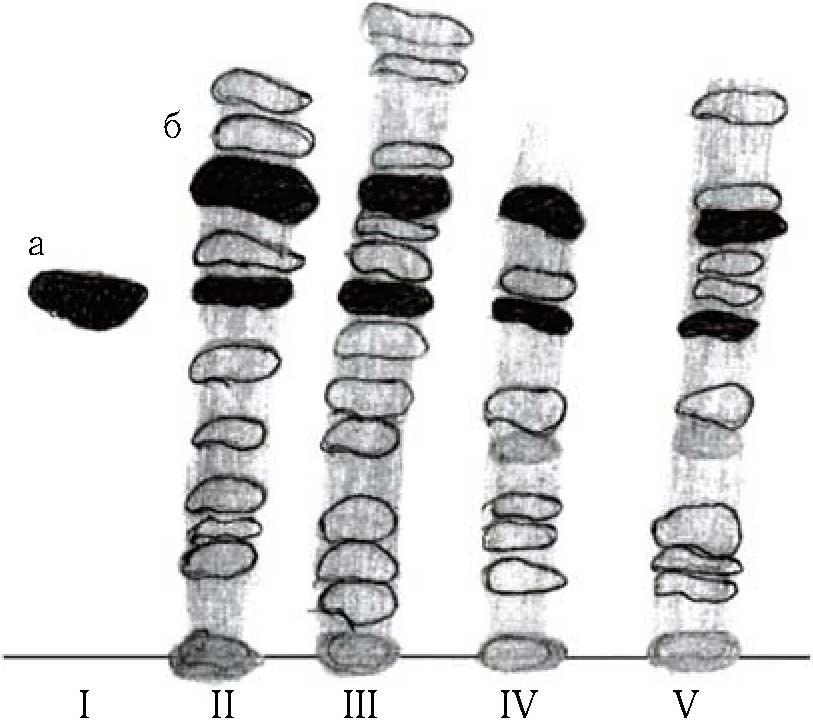
Рис. Тонкослойная хроматограмма исследуемых стильбенсодержащих фракций: 1 - а - индивидуальный ε-виниферин; 2 - стильбенсодержащая фракция кожицы винограда сорта Саперави; 3 - стильбенсодержащая фракция виноматериала сорта Саперави; 4 - стильбенсодержащая фракция кожицы винограда Каберне-Совиньон; 5 - стильбенсодержащая фракция виноматериала сорта Каберне-Совиньон; б - транс- ресвератрол.
35 - 40 min 50-100% В;
41 - 46 min 100% В;
46 - 48 min 100-20% В;
48 - 53 min 20% В.
Скорость подачи элюента - 1 мл/мин; инжектирование - 20 pl; при комнатной температуре, при длине волны 306 нм. Градиентный режим выбран по литературе [32].
Результаты и их обсуждение.
В стильбеносодержащих суммарных фракциях, полученных из кожицы винограда и столовых красных сухих вин, оказали ряд веществ. Среди них четко фиксируется и исследуемый е-виниферин (рис.). Совпадение индивидуального ε-виниферина к аналогичному веществу в исследуемых стильбенсодержащих суммарных фракциях, подтверждается с Rf-0,47; окрашиванием пятен при проявлении ТСХ диазотированной сульфаниловой кислоты; одинаковым свечением, под ультрафиолетовым облучением; аналогичными УФ- и ИК-спектральными данными; а также аналогичным пикам по времени выхода при ВЭЖХ. После идентификации ε-виниферина в кожицах винограда и вина, его концентрация определена по ВЭЖХ (табл.).
По полученным данным содержание ε-виниферина в винограде и виноматериале сорта Саперави, преобладает по концентрации по сравнению с выделенным из винограда и вина сорта Каберне-Совиньон.
Таблица
Содержание ε-виниферина в кожицах винограда и виноматериалах
Сорта винограда | В кожице, мг/100 г | В виноматериалах, мг/л |
Саперави | 0,74 | 0,98 |
Каберне-Совиньон | 0,39 | 0,40 |
Таким образом, в результате проведенного эксперимента, продолжая исследование стильбеновых веществ в виноградах красных сортов и приготовленных из них виноматериалов, изучены сорта Саперави и Каберне-Совиньон. Среди их богатых фенольных спектров в кожицах и самоосветлённых виноматериалах идентифицирован и количественно определён ε-виниферин. Вместе с идентифицированным нами резвератролом, определение ε-виниферина представляет собой важную теоретическую основу для исследования биологической активности и лечебно-питательной ценности грузинских красных вин.
Авторы приносят благодарность зав. центральной лаборатории Л.Шубладзе и инженеру-химику инструментального анализа Т. Сихарулидзе за проведение ВЭЖХ.
СПИСОК ЛИТЕРАТУРЫ
- Klatsky A. L., Armstrong М. A., Friedman G. D. Red wine, white wine, liquor, beer and risk for coronary artery disease hospitalization. American Journal of Cardiology. 1997, 80. - pp.
- Kondo K., Matsumoto A., Kurata H., Tanahashi H., Koda H., Amachi T., Itakura H. Inhibition of oxidation of Low-density Lipoprotein with red wine. Lancet. 1994, 344.- p. 1152.
- Balestrieri M. L., Schiano C., Felice F., Casamassimi A., Balestrieri A., Milone L., Sarvillo L., Napoli Cl. Effect of low doses of red Wine and Pure Resveratrol on Circulating Endothelial Progenitor Cells. Journal of Biochemistry, 2008, 143 (2).- pp. 179-186.
- Szmitko P. E., Verma S. Antiatherogenic potential of red wine: clinican update. Am Journal Physiol Heart Circ. Physiol. 2005, 288.- pp. 2023-2030.
- Araim O., Ballantyne J. Waterhouse Al., and Sumpio BE. Inhibition of vascular smooth muscle cell proliferation with red wine and red wine polyphenols. Journal of Vascular Surgery, 2002. vol. 35, 6.- pp. 1226-1232.
- Wellerath Th., Poleod., Li. H., Fyrstermann U. Red wine increases the expression of human endothelial nitric oxide synthase. J. Am. Coll. Cardiol. 2003, 41.- pp. 471-478.
- Micallef M., Lexis L., Lewandowski P. Red wine consumption increases antioxidant status and decreases oxidative stress in the circulation of bott young and old humans. Nutrition Journal. 2007, 6, 27.- p. 8.
- Renaud S., De Lorgeril M., Wine, alcohol, platelets and the French paradox for coronary heart disease. Lancet, 1992, 339.- pp. 1523-1526.
- De lange, D. W., van Golde P. H., Scholman W. L. G., Kraaijenhagen R. L, Akkerman J. W. N., Van de Wiel A. Red wine and red wine polyphenolic compounds but not alcohol inhibit ADP-induced platelet aggregation. Eur. J. Intern. Med. 2003, -pp. 361-366.
- Pace-Asciak C. R., Hahn S., Diamandis E. P., Soleas G., Goldberg D. M. Wines and grape juices as modulators of platelet aggregation in healty human subjects. Clin. Chim. Acta, 1995,235 - pp. 207-219.
- Teissedre, P. L., Frankel, E. N., Watherhouse, A. L., Peleg, H., german, J. B. Inhibition of in vitro human LDL oxidation by phenolic antioxidants from grapes and wines. J. Sci. Food Agric. 1996, 70.- pp.55-61.
- Frankel, E., Kanner, J., German, J. B., Parks, E., Kinsella,
- E. Inhibition of oxidation of human low density lipoprotein by phenolic substances in red wine. Lancet 1993, 341.- pp.454- 457.
- Дурмишидзе C.B. Дубильные вещества и антоцианы виноградной лозы и вина. Изд-во АН СССР. М. 1955.- 323с.
- Валуйко Г. Г. Биохимия и технология красных вин. Пищевая промышленность. М. 1973.- 295с.
- Квливидзе Д.Г., Бежуашвили МТ. Фенольные соединения в винограде сорта Саперави и столовых виноматериалов из него для вин, контролируемых по месту их происхождения. « Виноделие и Виноградарство». 2005. №2.-с.21- 22.
- Roggero, I. Р., Archier, Р. Quantitave determination of resveratrol and one of its glycosides in wines. Sci. Alimests 1994, 14.-pp. 99-107.
- Lamuela-Raventos, R. M., romero-Perez, A., Waterhouse, A. L., Torre-Bornat, M. C. Direct HPLC Analysis of cis- and trans-resveratrol and piceid isomers in Spanish red vitis vinifera wines. J. Agric. Food Chem. 1995, 43.- pp.281-283.
- Romero-Perez A. L., Lamuela — Raventos R. M., Waterhouse A. I. de la Torre-Boronat M. C. Levels of cis- and trans- rezveratrol and their Glucosides in white and Rose Vitis vinifera Wines from Spain. J. Agric. Food Chem. 1996, 44.- pp. 2124-2128.
- Lamuela-Rawentos R. M., Waterhouse A. I. Occurrence of Resveratrol and California wines by a new HPLQ method. J. Agric. Food Chem. 1993, 41.- pp. 521-524.
- Lamikarma O., Grimm С. C., Rodin B., Lnyang I. D. Hydroxylated stilbenes in Selected American Wines. j.Agric.food Chem. 1996, 44.- pp. 1111-1115.
- Langcake P., Pryce R. A New Class of Phytoalexins from Grapeviines. J. Experientia. 1977, vol. 33, N2.- pp. 151-
- Blond Y. P., Denis M. P., Bezard I. Antioxidant action of resveratrol in Lipid peroxidation. Sciences Aliments, 1995, 15.- pp. 347-358.
- Yang M., Gai L., Udeani G. O., Slowing К. V., Thomas C. F., Beecher C. W., Fong H. H., Fansworth N. R., Kinghorn
- D., Metha R. G., Moon R. C., Perruto Y. M. Cancer chemopreventive Activity of Resveratrol, a natural Product Derived from Grapes. Science, 1997, 275.- pp. 218-220.
- Docherty I. I., Me Ewen H. A., Sweet T. Y., Bailey E., Booth T. Resveratrol inhibition of Propionibacterium acnes. Journal of Antimicrobial chemotherapy. 2007, 59- pp. 1182-1184.
- Bertelli A. F., Giovenni L., Gianessi D., Miglior M., Bernini W., Fregoni M., Bertelli A. Antiplatelet activity of synthetic and natural resveratrol in red wine. Int. J. Tissue React. 1995, 17.- pp. 1-3.
- Cullen I. P., Morrow D., Jin Y., Curley B., Borinson A., Sitzmann I. V., Cahill P. A., Redmond E. M. Resveratrol, a Polyphenolic Phytostilbene, Inhibits sis and Secretion. Journal of Vascular Research. 2007, 44.- pp. 75-84.
- Ribeiro de Lima, M. T., Waffo Heguo, P., Tessedre, P. L., Pujolas, A., Vercauteren, I., Cabanis, I. C., Merillon, I. M. determination of stilbenes (trans-astrigin, cis- and trans- piceid, and cis- and trans-resveratrol) in Portuguese wines. J. Agric. Food Chem. 1999, 47.- pp.2665-2670.
- Carando, S., Teissedre, P. L., Waffo-Teguo, P., Cabanis,
- C., Deffieux, G., Merillon, I. M. High performance liquid chromatography caupled with fluorescence detection for the determination of trans-astringin in wine. J. Chromatogr. A 1999, 849.- pp.617-620.
- Baderschneider, B., Winterhalter, P., Isolation and characterization of novel stilbene derivatives from Risling wine. J. Agric. Food Chem. 2000, 48.- pp.2681-2686.
- Landrault, L, Merillon, I. M., Case, F., Gros, G., Teissedre, P., L. levels of stilbene oligomers and astilbin in French varietal wines and in grapes during noble rot development. J. Agric. Food Chem. 2002, 50. - pp.2046-2052.
- Vitrac, X., Bornet, A., Vaderlinde, R., Delannay, I. C., Merillon, I. M., Teissedre, P. L. Determination of stilbenes (8-viniferin, trans-astringin, trans-piceid, cis- and trans-resverattol, ε-viniferin) in Brazilian Wines J. Agric. Food Chem. 2005, 53.- pp.5664-5669.
- Guebailia H. A., Chilra K., Richard T., Mabrouk T., Furiga A., Vitrac X., Monthi Jean-Pierre, delaunay Yean-Claude, Merillon Yean-Michael. Hopeaphenol: The first resveratrol Tetramer in Wines from North Africa. J. Agric. Food Chem. 2006, 54.- pp. 9559-9564.
- Do, Quoc-Tuanl, Renimal; Isabellel; Andre Patricel; Lugnier Clarel; Muller Christian D. L.; Bernard Philippe. Reverse Pharmacognosy: Application of Selnergy, a New Tool for Lead Discovery. The Example of Viniferin. Current Drug Discovery Technologies, 2005, vol. 2.- pp. 161-167.
- Shizuo Toda, Yoshiaki Shirataki. Inhibitory Effects of Resveratrol Oligomers in Sophora mooracroftiana on Lipid Peroxidation by Superoxide Anion. Pharmaceutical Biology, 2004, vol. 42, N1.- pp. 55-58.
- Billard C. Izard I. C., Roman V., Kern C., MAthiot C., Mentz F., Kolb I. P., Comparative Antiproliferative and Apoptotic effects of Resveratrol, viniferin and Vine — shots Derived Polyphenols (Vineatrols) on Chronic В Lymphocytic Leakemia Cells and Normal Human Lyphocutes. Leukemia and Lymphoma. 2002, vol. 43, N10.- pp. 1991-2002.
- Bertrand Piver, Francois Berthou, Yvonne Dreano and Daniele Lucas. Differential inhibition of human cytochrome P450 enzymes by-viniferin, the dimer of resveratrol: comparison with resveratrol and polyphenols from alcoholized beverages. Journal of Phytopathology. Publisher: Blaskwell Publishing. 2003.
- Christelle Privat, Yoao Paulo Telo, Vania Bernands — Genisson, Abel Vieira, Yean-Pierre Souchard and Francoise Nepveu. Antioxidant Properties of trans-e-viniferin As Compared to Stilbene Derivatives in Aqueous and Nonaqueous Media. J. Agric. Food Chem., 2002, 50(5).- pp. 1213-1217.
- Bavaresco L., Vezzulli S., Civardi S., Gatti M., Battilani P., Pietri A., Ferrari F. Effect of Limeinduced Leaf chlorisis on ochratoxin A, trans-resveratrol, and epsilon-viniferin production in grapevine (Vitis vinifera L.) berries infected by Aspergillus carbonaricus. J. Agric. Food Chem, 2008, Vol, 56, Issue 6.- pp. 2085-2089.
- Gindro K., Viret O., Spring Y. — L. Developpement docitils pour la selection precole de cepages resistents au mildiou. Revue suisse Vitic. Arboric. Hortic. 2007, Vol. 39 (2).- pp. 133-139.
- Piver B., Berthou F., Dreano Y., Lucas D. Differential inhibition of human cytochrome P450 enzymes by e-viniferin, the dimer of resveratrol: Comparison with resveratrol and polyphenols from alcoholized beverages. Life Sci. 2003, 73.- pp. 1199-1213.
- Бежуашвили M.Г., Муджири А.А., Куркин В.A., Запесочная Г.Г. Ресвератрол из виноградной лозы. Химия древесины, 1991. т 6.- С. 75-76.
- Бежуашвили М.Г. Разработка теоретических основ конверсии лигнина древесины дуба и виноградной лозы и определение путей использования полученных продуктов. Докторская диссертация. 1994. - 324 с. Тбилиси.
- Бежуашвили М.Г., Муджири Л.А., Шашков А.С., Чижов О.С., Стомахин А.А. Стильбеновые тетрамеры из однолетних побегов виноградной лозы. Биоорганическая химия. 1997, т.23(12). - С. 979-987.
- Кохташвили М.Г., Бежуашвили М.Г. Идентификация транс-ресвератрола в некоторых красных сортах винограда. Georgian Engineering News. 1998, №4. - с. 104-106.
- Кохташвили М., Бежуашвили М., Патарая М. Исследование транс-ресвератрола в сухих столовых красных винах. Сборник трудов Груз. аграрного университета. Тбилиси, 2002, т. 19.- с. 79-86.
- Кохташвили М., Патарая М., Бежуашвили М. Влияние ресвератрола на интенсивность развития некоторых винных дрожжей. Лоза и вино. 1999, №1.- С. 47-54.
- Бежуашвили М., Кохташвили М., Ломтатидзе З.М., Мамулашвили К.С. Влияние транс-ресвератрола на рост и развитие некоторых микроорганизмов. Сборник научных трудов аспирантов и соискателей. 1999, т. IV.- с. 210-213.
- Бежуашвили М., Месхи М.Ю., Бостоганашвили М.В., Малания М.А. Антиоксидантная активность стильбенсодержащего экстракта в опытах «in vitro». Виноделие и Виноградарство. 2005, № 3.- С. 26-27.

