До первой половины XX в. господствовало мнение, что сивушные спирты образуются только из продуктов гидролиза белков, главным образом из аминокислот согласно механизму, предложенному Ф. Эрлихом.
В настоящее время доказано, что сивушные спирты образуются как из аминокислот, так и из сахаров.
Рассмотрим вначале образование сивушных спиртов из аминокислот.
Работами Эрлиха было показано, что при добавлении в бродящий сахарный раствор лейцина образуется 80—87% изопентанола и пентанола, а при введении в бродящую среду фенилаланина и тирозина возникают β-фенилэтанол и тиразол.
Согласно теории Эрлиха образование высших спиртов осуществляется двумя путями. Первый путь — это декарбоксилированные аминокислоты с образованием амина с последующим его дезаминированием и гидратйрованием в соответствующий спирт. Второй путь — это гидролитическое дезаминирование аминокислоты, в результате чего образуется оксикислота и аммиак. Затем оксикислота, декарбоксилируясь и восстанавливаясь, переходит в соответствующий спирт. Оба процесса можно представить в следующем виде:

Из углеродного скелета аминокислоты образуется спирт, содержащий на один атом углерода меньше, чем исходная аминокислота.
О. Нейбауэр и К. Фромхерц изменили первую часть последнего уравнения. Они считают, что первым промежуточным продуктом окислительного дезаминирования является кетокислота, которая, декарбоксилируясь, образует углекислоту и альдегид (последний восстанавливается в спирт):
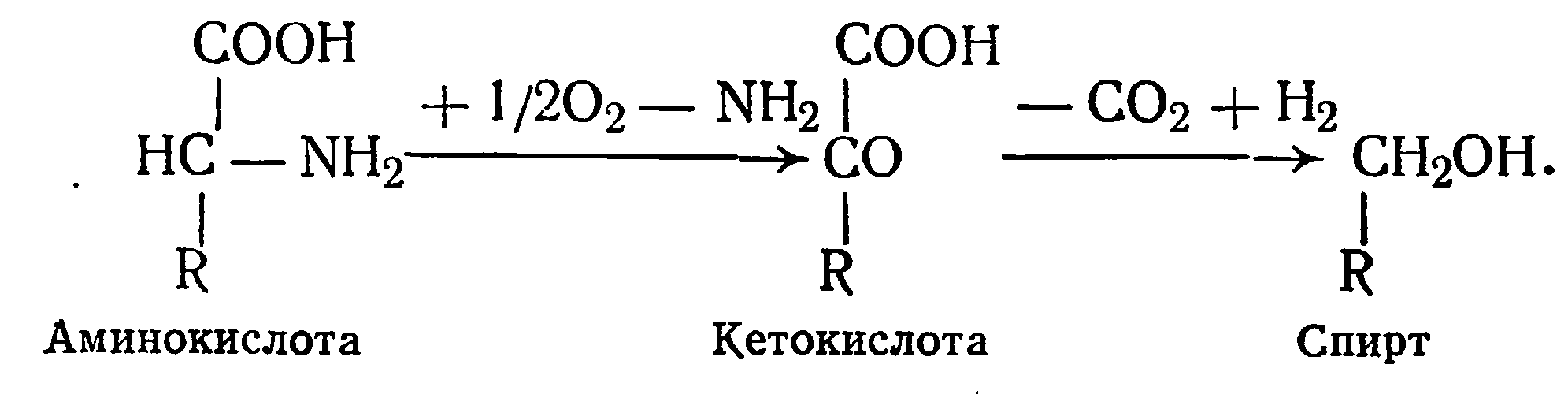
Так образуются сивушные спирты из продуктов гидролиза белков, в частности из аминокислоты.
Исследования Η. М. Сисакяна, И. Я. Веселова и Л. Женевуа, а также других ученых показали, что путь образования сивушных спиртов из аминокислот не является единственным. Эти исследования указали на то, что теоретические расчеты между ассимиляцией аминокислот дрожжами и образованием сивушных спиртов находились в несоответствии с результатами экспериментальных данных. В конце брожения количество сивушных спиртов всегда больше, чем должно было быть по теоретическим расчетам. Это несоответствие объясняется тем, что сивушные спирты могут образовываться и из сахаров. Это подтвердилось в работах Е. Пейно и Г. Гимберто, Ж. Риберо-Гайона и Е. Пейно, Т. Аираппа, И. Кэстора и И. Гимона.
Эти исследователи установили, что аминокислоты ассимилируются дрожжами из среды раньше, чем появляются сивушные спирты. Количество аминокислот быстро уменьшается в первые 18—35 ч брожения. Рост и размножение дрожжей продолжается до 45—50 ч, тогда как основное количество сивушных спиртов обнаруживалось лишь после прекращения роста дрожжей И. Кэстор и И. Гимон объясняют это явление образованием кетокислот, согласно теории О. Нейбауера. При этом авторы нашли, что к концу брожения выход сивушных спиртов в 2,5 раза больше теоретического.
Таким образом, теория Эрлиха не может объяснить, почему не получается баланс между количеством ассимилируемых дрожжами аминокислот и содержанием образовавшихся сивушных спиртов.
Согласно данным Ф. Драверта (1963 г.), содержание в винограде лейцина около 56 мг/л, изолейцина 22,3 мг/л, а виноградном соке еще меньше — до 32 мг/л лейцина и 16 мг/л изолейцина.
Таблица 13
ОБРАЗОВАНИЕ ЛЕТУЧИХ КОМПОНЕНТОВ В МОДЕЛЬНЫХ ОПЫТАХ С САХАРОМ И РАЗЛИЧНЫМИ КОНЦЕНТРАЦИЯМИ АМИНОКИСЛОТ
| Аминокислоты, мг/л | Количество соответствующего аминокислотам азота, мг/л | Продукты брожения, мг/л | ||||
Этанол | Пропанол-1 | Изобутанол | Пентанол | Сумма | ||
72,0 | 12,0 | 15,0 | 5,0 | 31,0 | 270,0 | 306,0 |
216,0 | 36,2 | 13,0 | 5,0 | 43,0 | 235,0 | 283,0 |
366,0 | 60,0 | 13,0 | 7,0 | 52,0 | 198,0 | 257,0 |
723,0 | 121,0 | 14,0 | 8,0 | 50,0 | 163,0 | 221,0 |
1445,0 | 242,0 | 10,0 | 18,0 | 84,0 | 157,0 | 259,0 |
3612,0 | 603,0 | 11,0 | 16,0 | 96,0 | 134,0 | 246,0 |
Следовательно, по механизму Эрлиха в винах в среднем может образовываться около 23—25 мг/л изопентанола и 10—12 мг/л активного пентанола. Что касается образования изобутанола, то его количество должно быть еще меньше, так как содержание валина не превышает 10—15 мг/л в виноградном соке.
А между тем в виноградных винах количество сивушных спиртов достигает до 300—350 мг/л. Следовательно, по теории Эрлиха можно объяснить образование только одной десятой части сивушных спиртов, получающихся из аминокислот в процессе алкогольного брожения.
Таким образом, нет прямой зависимости между содержанием аминокислот в виноградном соке и количеством образовавшихся сивушных спиртов в вине.
Исследованиями А. Раппа и X. Франка [152] установлено, что концентрация аминокислот лишь до определенных количеств увеличивает содержание сивушных спиртов. Образование пропанола, изобутанола, изопентанола и активного пентанола во время спиртового брожения по-разному зависит от концентрации аминокислот.
В табл. 13 приведены данные, показывающие, как изменяется количество образовавшихся сивушных спиртов с изменением концентрации сахара (по А. Раппу и X. Франку).
Из данных, приведенных в табл. 13, видно, что из 72,0 мг/л аминокислот образовалось 306,0 мг/л сивушных спиртов. Это свидетельствует о том, что в основном сивушные спирты возникают из сахара. При увеличении количества аминокислот общее содержание сивушных спиртов уменьшается за счет уменьшения пентанолов, в то время как концентрация изобутанола значительно увеличивается.
Таким образом, с увеличением концентрации аминокислот соотношение между образовавшимися высшими спиртами меняется.
Количество пропанола и изобутанола растет, а содержание пентанолов падает. Было показано также, что нет прямой зависимости между содержанием аминокислот в сусле и образованием высших спиртов [152]. Наоборот, существует мнение о прямой зависимости между концентрацией сахара и образованием фенилэтанола в процессе алкогольного брожения. Образование этого спирта из сахара было показано С. Саписом и Ж. Риберо-Гайоном.
Некоторые ученые считают, что сивушные спирты образуются в результате переаминирования аминокислот с кетокислотами. В 1958 г. С. Антониани с сотрудниками показал, что треонин, триптофан, тирозин, цистеин и глютатион увеличивают выход сивушных спиртов, а метионин, цистин, α-аминомасляная кислота задерживают их образование.
И. Я. Веселов (1964 г.) установил, что при добавлении к обедненной азотистыми веществами среде α-аминомасляной кислоты в результате брожения выход сивушных спиртов увеличивается в 5—7 раз, а при внесении α-аланина — в 2 раза; β-аланин, γ-ами- номасляная кислота, серин, тирозин и глицерин не оказывают значительного влияния на образование сивушных спиртов.
Е. Пейно и Г. Гимберто показали, что при брожении таких аминокислот, как цистеин,, глицин, гистидин, пролин, серин, треонин, образуются значительные количества изобутанола и изопентанола.
Они объясняют это явление реакцией трансаминирования кетокислот дрожжами.
А. К. Родопуло, И. А. Егорова и Η. Т. Саришвили (1963) обнаружили, что при брожении аминокислот, за исключением лейцина и изолейцина, на синтетической среде образование сивушных спиртов протекает не по схеме Эрлиха. Так, из глицина, аланина, треонина аспарагиновой и глютаминовой кислот образуются сивушные спирты с более длинной углеродной цепью, чем у исходной аминокислоты.
Механизм образования изобутилового спирта из глицина следующий: вначале глицин превращается в аланин, а последний — в валин, который образует изобутанол.
Изопентанол образуется из глютаминовой кислоты по следующей схеме: глютаминовая кислота аланин →валин→ лейцин →изопентанол.
н-Пропанол образуется из треонина через α-аминомасляную кислоту.
Основными продуктами брожения исследуемых аминокислот были изопентанол, изобутанол и н-пропанол. В этих исследованиях показана связь между синтезом сивушных спиртов из низкомолекулярных аминокислот и теорией Эрлиха.
Важное значение при этом придается аланину, через который наращивается углеродная цепочка других аминокислот. Аналогичное явление наблюдал И. Я. Веселов: при введении в сбороженную среду пировиноградной кислоты увеличивалось накопление сивушных спиртов И. Я. Веселов (1961) считал, что участие в биосинтезе сивушных спиртов пировиноградной кислоты и аминокислот свидетельствует о неразрывной связи углеводного и азотистого обмена веществ в дрожжевой клетке, т. е. можно считать, что в присутствии пировиноградной кислоты образование сивушных спиртов протекает в дрожжевой клетке двумя путями. Первый путь — это реакция переамирования аминокислот сусла и дрожжевой клетки с кетокислотами (главным образом с пировиноградной кислотой) и дальнейшее образование высших спиртов по схеме Ф. Эрлиха или О. Нейбауэра. Реакцию переаминирования можно представить в следующем виде:

И. Я. Веселов считает, что если количество азотистых веществ, необходимых для аминирования или переаминирования, недостаточно, то кетокислоты накапливаются в среде до тех пор, пока дрожжи переобразовывают их в соответствующие сивушные спирты. Таково мнение и П. Бидана [103].
Второй путь образования сивушных спиртов из пировиноградной кислоты можно рассматривать, как биосинтез спиртов из углеводов. Известно, что в начале сахар распадается до пировиноградной кислоты, затем, по схеме К. Иошицава и других, эта кислота конденсируется с уксусным альдегидом или с ацетил-КоА, образуя ацетомолочную кислоту, которая превращается в α-кето- изовалериановую кислоту. Последняя, декарбоксилируясь, дает изомасляный альдегид, который в присутствии НАД-Н2 и алкогольдегидрогеназы восстанавливается в изобутанол.
Образование изопентанола можно рассматривать как конденсацию α-кетоизовалериановой кислоты с ацетил-КоА, при этом получается α-кетоизокапроновая кислота, которая, декарбоксилируясь, превращается в изовалериановый альдегид. Последний в присутствии НАД-Н2 и алкогольдегидрогеназы образует изопентанол. Процесс проходит по следующей схеме.

Таким образом синтезируются изобутанол и изопентанол из пировнноградной кислоты, вернее, из углеводов. Этот механизм впервые был выдвинут К. Иошицава и М. Ямада (1966). В последнее время он все больше получает экспериментальное подтверждение.
Исследования Т. Аираппа [99] показали, что при добавлении к бродящей среде меченого С14 лейцина образуется только радиоактивный 3-метилбутанол, а в присутствии меченого С14 валина радиоактивными становятся и бутанол, и 3-метилбутанол.
Это свидетельствует о присутствии в бродящей среде валина, лейцина и изолейцина, сивушные спирты образуются по схеме Ф. Эрлиха. Этот автор также показал, что при низкой концентрации аминокислот большая часть β-фенилэтанола образуется из фенилаланина, а при повышенной концентрации аминокислот β-фенилэтанол синтезируется из сахара.
Известно, что если дрожжи облучать ультрафиолетом, то они теряют способность синтезировать лейцин, изолейцин и валин. Полученные мутанты дрожжей также теряют способность синтезировать изопентанол, активный пентанол и изобутанол.
При сбраживании глюкозы мутантным штаммом дрожжей с уксусной кислотой, меченой в положении в 1-С14 и 2-С14, она активно включается в н-бутанол. Наоборот, при сбраживании глюкозы исходным немутантным штаммом дрожжей меченая уксусная кислота в основном включается в изопентанол. Добавление норвалина при сбраживании глюкозы мутантным штаммом приводит к образованию как н-бутанола, так и н-пнетанола. В присутствии норлейцина в качестве источника α-кето-н-капроновой -кислоты в среде увеличивалось образование н-пентанола.

Регулирование образования сивушных спиртов при брожении
Таким образом, можно считать, что н-пропанол образуется в основном из α-кето-н-масляной. кислоты, н-бутанол — из а-кето-н- валериановой кислоты, а н-пентанол — из α-кето-н-капроновой кислоты, т. е. образование высших н-спиртов происходит по следующей схеме:
Многие исследователи считают, что повышенное количество сивушных спиртов вызывает сивушный привкус в вине и особенно в коньяках. Поэтому регулирование образования сивушных спиртов имеет большое значение для получения качественных сухих вин и коньяков.
Известно, что при добавлении аммонийных солей к бродящему суслу наблюдается значительное снижение образования сивушных спиртов. Это свидетельствует о том, что часть сивушных спиртов образуется из аминокислот, т. е. если в среде имеются различные формы азота, легко ассимилируемые дрожжами, το образуется меньше сивушных спиртов.
Эрлих показал, что если в бродящий раствор сахара добавлять лейцин, изолейцин, фенилаланин и тирозин, то из них возникают изопентанол, пентанол, β-фенилэтанол и тиразол, выход этих спиртов составляет 80—85%. Показано также, что эти спирты не образуются из указанных выше аминокислот при отсутствии сахара. Количество высших спиртов сильно снижается, если к бродящей среде добавить соли аммония.
Объясняется это тем, что дрожжи в присутствии аммонийных солей не используют аминокислоты для азотистого питания, поэтому из них не образуются сивушные спирты. Наоборот, дрожжи в присутствии солей аммония синтезируют недостающие аминокислоты из углеводов и аммония для конструктивного обмена и образования биомассы. В этих условиях синтез сивушных спиртов происходит главным образом из углеводов, поэтому количество их значительно ниже, чем при нормальном спиртовом брожении.
Наши исследования показали, что аммонийные соли изменяют реакцию среды, так как при использовании дрожжами аммиака от аммонийных солей в среде остается кислотный остаток. Поэтому мы рекомендуем вместо аммонийных солей для регулирования образования сивушных спиртов применять мочевину. Однако, винные дрожжи быстро разлагают мочевину на аммиак и углекислоту, которая в процессе брожения выделяется, а аммиак быстро используется дрожжами для построения биомассы.
Образование сивушных спиртов при алкогольном брожении зависит еще и от многих других факторов. Особо важное значение среди них имеют состав среды, и раса дрожжей, концентрация водородных ионов (pH среды), температура и концентрация кислорода при брожении сусла. В нормальных условиях сивушных спиртов образуются от 162 до 366 мг/л (в среднем 250 мг/л). По данным Е. Пейно и Г. Гимберто (1968), в красных бордоских винах содержится в среднем 394 мг/л, в белых винах 309 мг/л; Радлер нашел в немецких винах от 81 до 543 мг/л сивушных спиртов.
Е. Пейно и Г. Гимберто исследовали влияние аэрации на образование сивушных спиртов и установили, что при аэробиозе количество их увеличивается. В анаэробных условиях сивушных спиртов образуется в среднем 214 мг/л, а в аэробных 150 мг/л. Однако, работами А. Г. Канна и И. М. Грачевой, было показано, что количество сивушных спиртов зависит от средней интенсивности аэрации.
Исследованиями К. Иошицава (1966) установлено, что оптимум образования изобутанола и изопентанола лежит при концентрации кислорода 7 -10-2 г-моль/мин. Выше этой концентрации количество спиртов уменьшается.
Наши исследования, проведенные совместно с Н. Д. Чичашвили и А. В. Кавадзе [78], также показали, что наибольшее количество высших спиртов образуется при средней интенсивности аэрации и что во всех случаях переключение обмена веществ с брожения на дыхание влечет за собой уменьшение образования сивушных спиртов на единицу биомассы дрожжей.
Было показано, что один и тот же вид дрожжей и даже одна и та же раса образует разное количество сивушных спиртов в зависимости от концентрации растворенного кислорода в бродящей жидкости. Так, дрожжи Sacch. vini в анаэробных условиях образуют больше изобутанола и изопентанола, чем в аэробных; Sacch. oviformis в аэробных условиях синтезируют больше изопентанола и активного пентанола, чем при анаэробиозе, т. е. четкой картины нет, и ни один из исследователей не дает объяснения, почему при проведении брожения в аэробных условиях образуется больше сивушных спиртов, а в анаэробных условиях меньше, и наоборот.
Во-первых, это зависит от состава среды: если сусло содержит значительные количества лейцина, изолейцина, валина, треонина, то образование сивушных спиртов из этих аминокислот протекает по схеме Эрлиха; в этом случае нет необходимости в присутствии кислорода [21]. Если же этих аминокислот мало, то образование высших спиртов в основном происходит из сахара. В этом случае, как показано выше, биосинтез высших спиртов происходит через ацетил-КоА, который образуется в аэробных условиях. На образование ацетил-КоА не требуется больших количеств кислорода. А при избытке кислорода образовавшийся изомасляный альдегид не восстанавливается в изобутанол и процесс протекает в сторону образования ацетоина и диацетила.
Объяснением того, почему при аэрации бродящего сусла количество изобутанола увеличивается, а количество пропанола уменьшается является следующее: синтез изобутанола из сахара протекает через ацетил-КоА, для образования которого требуется кислород, а для синтеза пропанола он не нужен, так как пропанол в основном образуется из α-кетомасляной кислоты и при этом ацетил-КоА не требуется.
Многие исследователи считают [16], что оптимальной температурой для образования сивушных спиртов является 20—25°С, т. е. температура, совпадающая с оптимальной температурой размножения дрожжей.
Е. Пейно и Г. Гимберто (1962) исследовали образование спиртов в процессе брожения при температуре от 15 до 35°С и установили, что максимальное образование изобутанола и изопентанола происходит при 20—25°С.
И. Я. Веселов, И. М. Грачева и др. показали, что брожение сусла при температуре 8—20° С приводит к накоплению сивушных спиртов и количество их увеличивается примерно в 1,8 раза; при дальнейшем повышении температуры до 30°С содержание их уменьшается в 2,6 раза, в основном за счет изопентанола [16].
Работами Б. Ренкаина (1967 г.) установлено, что влияние температуры на образование сивушных спиртов зависит от вида и расы дрожжей. Автор исследовал 11 рас винных дрожжей, сбраживающих сусло при температуре от 15 до 25°С. При этих условиях дрожжи образуют 24% изобутанола и активного пентанола, около 39% изопентанола и 17% н-пентанола. При 25°С количество изопентанола и изобутанола продолжает увеличиваться, а количество н-пропанола уменьшается. Брожение, проведенное при 38°С, приводит к образованию значительно больших количеств этанола, пировнноградной и α-кетоглутаровой кислот, чем брожение при 25°С. Это объясняется замедленным дыханием дрожжей, что увеличивает выход спирта.
Известно, что существует зависимость между ростом и размножением дрожжей и количеством образующихся сивушных спиртов. Так, если рост и размножение дрожжей ограничивать различными способами, то высших спиртов образуется гораздо меньше. При медленном брожении высших спиртов образуется больше, чем при интенсивном.
При непрерывном брожении размножение дрожжей очень ограниченно, высших спиртов образуется меньше, а качество вина получается лучше, чем при периодическом.
Известно также, что при непрерывном культивировании дрожжей метаболическая активность изменяется в зависимости от их скорости роста и размножения. Количество сахара в среде влияет на скорость размножения дрожжей и, следовательно, на дыхание. При низких дозах сахара дыхание подавляет брожение, а при высоких брожение подавляет дыхание. Это было показано Н. Г. Саришвили и др. [86].
Особое значение имеет брожение под давлением СO2, который способствует перестройке обмена веществ дрожжей. При этом преимущественно получаются вина высокого качества с низким редокспотенциалом, меньшим содержанием кислот и высших спиртов с сохранением фруктовых тонов в букете и аромате. Этот способ получил широкое применение в ФРГ (Geiss, 1950).
Концентрация водородных ионов также влияет на количество образовавшихся высших спиртов в процессе спиртового брожения. Так, например, по данным Е. Пейно и Г. Гимберто, при pH 2,6 наблюдается минимальное образование сивушных спиртов, а при pH 3—5 количество их увеличивается. При pH>5,0 количество их заметно уменьшается.
Аналогичные результаты были получены и Б. Ренкаином.

