Истинная кислотность вина, которая колеблется от 2,5 до 3,7, совместно с концентрацией этилового спирта предохраняет его от бактериальных заболеваний.
В интенсивности протекания окислительных реакций заметную роль играет кислотность вина. В кислой среде, какой является вино, окислительные процессы протекают гораздо медленнее, чем в нейтрально-щелочной. В кислой среде двухвалентное железо слабо окисляется в трехвалентное, что препятствует образованию танатов железа, вызывающих железный касс. Высокая кислотность придает вину устойчивость к феррофосфатным помутнениям.
Π. Н. Унгурян (1960) отметил, что существует определенная закономерность возникновения феррофосфатных помутнений, связанных с количественным содержанием в вине железа, фосфора и титруемой кислотностью. Таким образом, чем выше титруемая кислотность и чем меньше железа и фосфора в вине, тем оно устойчивее к феррофосфатным помутнениям.
Активная кислотность винограда имеет важное значение при выработке вина. При низких значениях pH (2,9—3,7) окислительные ферменты (о-дифенолоксидаза, пероксидаза и аскорбатоксидаза) менее активны. Поэтому окислительные процессы при обработке винограда и получении сусла протекают слабее, вследствие чего вино получается менее окисленным.
Работами М. А. Герасимова, В. З. Гваладзе, Η. М. Сисакяна и др. установлено, что между активной и титруемой кислотностью в виноградном соке и вине нет прямой зависимости. Так, вина с равной титруемой кислотностью отличаются концентрацией водородных ионов. Это понятно, потому что титруемая кислотность определяет не только фракцию свободной недиссоциированной кислоты, но и половину фракции одновалентных ионов у двухосновных кислот.
Активная кислотность и щелочность вина обусловлены наличием ионов Н+ и ОН-. Исходя из этого, С. Серенсен предложил характеризовать кислотность и щелочность в биологических средах посредством pH, т. е. отрицательным логарифмом концентрации водородных ионов.
Кислотность и щелочность определяются величиной, обозначенной pH, причем![]() . Так, в кислом рас
. Так, в кислом рас
творе, в котором (Н+) равно 10-3, pH равно 3, а в нейтральном растворе, где (Н+) равно 10-7, pH равно 7. По степени кислотности сумма ионов (Н+) и ОН- меняется, только в нейтральной точке она минимальная. Б этой точке число ионов Н+ равняется числу ионов ОН-.
Сила кислоты характеризуется ее константой диссоциации и обозначается буквой К. 'Отрицательный логарифм константы диссоциации обозначается рК. У сильных кислот рК — около 1, у слабых — 3—6 и выше. Сильные кислоты, например соляная и серная, нейтрализуются при pH 7,0, в то время как слабые кислоты — в щелочной зоне. Уксусная кислота нейтрализуется при pH 8,4.
По константам диссоциации органические кислоты, встречающиеся в виноградном сусле и вине, характеризуются следующими данными: винная 9,7· 104, лимонная 8,2· 10-4, яблочная 3,95-10-4, янтарная 6,65-10-5, молочная 1,4-10-4 и уксусная 1,8-5. Из этих данных видно, что наиболее сильными кислотами являются винная и лимонная.
Активная кислотность зависит главным образом от содержания в вине наиболее сильно диссоциированных кислот.
Органические кислоты в вине имеют важное значение для его вкуса. Одни авторы считают, что вкусовая кислотность зависит от концентрации водородных ионов, состава органических кислот, от буферности, другие утверждают, что относительная вкусовая кислотность больше зависит от молекулярных концентраций кислот, чем от pH.
Некоторые органические кислоты имеют свой собственный характерный вкус и аромат. Так, лимонная кислота придает вину свежесть, янтарная кислота имеет необычный солено-горький вкус, в то время как большое количество яблочной кислоты вызывают зеленый привкус.
Т. Мунц считает, что яблочная кислота проявляет различные вкусовые оттенки в зависимости от концентрации этанола, дубильных кислот, сахаров, ароматических и минеральных веществ. Путем количественного изменения соотношения указанных веществ можно достичь во вкусе различной гармоничной кислотности.
В создании буферности участвуют больше всего ионы калия, наряду с ними в небольших количествах — ионы Са++, Mg++ и Na+. В шампанских винах кислотная гармоничность регулируется количеством сахара и углекислоты.
Исследования Л. Усселио-Томасса (1963) показали, что добавлением в вино кислотопонижающих веществ (К2СО3 и СаСO3) и кислотоповышающих (винная кислота) нельзя добиться урегулирования буферной силы. Установлено, что при понижении кислотности дозами 2,58 г/л СаСO3 и 3,58 г/л К2СО3 pH вина повышается от 2,98 до 3,98 и титруемая кислотность снижается от 13,57 до 12,41 г/л.
В низкокислотных винах из-за высокой буферной силы для понижения pH требуются высокие дозы винной кислоты (в 2,5 раза превышающие рассчитанное количество минеральной кислоты). Так, чтобы понизить pH от 3,8 до 3,3 в вино потребовалось добавить 4,2 г/л винной кислоты. Это повысило титруемую кислотность от 5,2 до 9,22 г/л, т. е. выше допускаемых норм.
В связи с этим интересно отметить, что значение pH буферной смеси, которое как раз достигает порогового значения кислого вкуса, лежит значительно выше (приблизительно pH 6), чем значение pH соответственно чистых растворов кислоты. Добавление сахара к раствору кислот уменьшает кислый вкус. Известно также, что соль может влиять на кислый вкус напитка. Этиловый спирт значительнее уменьшает ощущение кислого вкуса вина, чем сахара и соли.
Этиловый спирт подавляет диссоциацию кислот. Для осуществления регулирования вкусовой кислотности вина рекомендуется применять ионообменные смолы.
Продукты взаимодействия органических кислот со спиртами (эфиры), а также продукты их распада (например, промежуточные продукты разложения винной кислоты) играют важную роль в формировании органолептических свойств вина.
В виноделии известно, что качество вина зависит не только от сорта винограда, почвенно-климатических условий, но и от биохимических процессов, протекающих при технологии. Для получения качественной продукции важно установить время сбора винограда, при этом основными показателями зрелости являются содержание сахара и кислотность.
Отношение количества сахара к общей кислотности, выраженной в граммах на 1 л, называется глюкоацидометрическим показателем.
Η. Н. Простосердов считает, что глюкоацидометрический показатель является индексом созревания винограда [69]. Он определяет время сбора винограда и указывает степень зрелости его, необходимую для получения различных типов вин. Для приготовления столовых сухих вин глюкоацидиметрический показатель равен 25, для десертных 35, а для шампанских 20.
При повышении глюкоацидиметрического показателя, помимо увеличения содержания сахара и уменьшения титруемой кислотности, увеличивается также количество фенольных и азотистых соединений (особенно белкового азота). При полной физиологической зрелости содержание фенольных и белковых веществ уменьшается.
Известно, что органические кислоты накапливаются в ягодах винограда до момента, когда начинается налив ягоды и концентрация сахара заметно возрастает. При этом заметно уменьшается накопление органических кислот, титруемая кислотность резко падает.
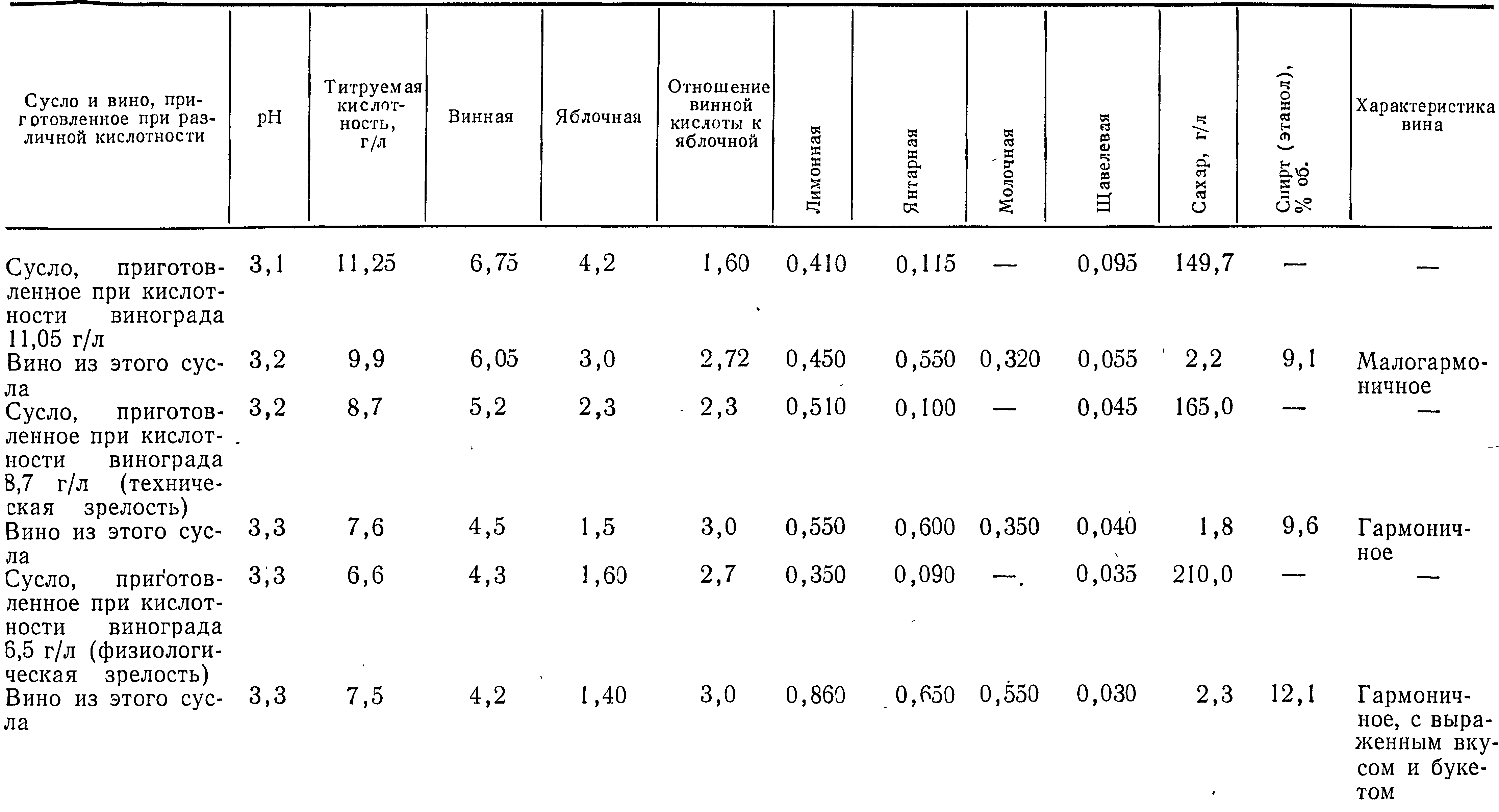
Изменение содержания органических кислот и сахаров в процессе созревания винограда и в период алкогольного брожения показано в табл. 18.
Из приведенных в табл. 18 данных видно, что при сбраживании сусла с высокой титруемой кислотностью (11,25 г/л) по окончании брожения наблюдается уменьшение кислотности до г/л, при этом количество винной и яблочной кислот уменьшается, а количество лимонной и янтарной кислот увеличиваются. Наблюдается образование молочной кислоты, которая отсутствует в винограде. Полученное вино при такой высокой кислотности имело кислый привкус и было малогармоничным.
Вино, приготовленное из винограда технической зрелости, по вкусу было мягче, гармоничнее предыдущего. Интересно отметить, что при сбраживании сусла с более низкой кислотностью (6,5 г/л) по окончании брожения кислотность увеличилась (до 7,5 г/л). Винные дрожжи как бы регулируют кислотность среды.
В сусле с высокой кислотностью содержится сравнительно большое количество винной и яблочной кислот, которые придают вину резкий вкус, называемый «зеленой кислотностью».
В процессе сбраживания содержание яблочной кислоты уменьшается быстрее, чем винной. Вероятно, титруемая кислотность уменьшается главным образом за счет яблочной кислоты, но все же она остается еще достаточно высокой, чтобы придать вину привкус зеленого винограда. Уменьшение винной кислоты обусловлено ее меньшей растворимостью в спиртовой среде, вследствие чего она частично выпадает в осадок. Содержание, лимонной и янтарной кислот все время увеличивается, а щавелевой уменьшается.
В процессе брожения содержание яблочной кислоты уменьшается, количество лимонной увеличивается, однако эквивалентного образования лимонной кислоты не наблюдается. Видимо, яблочная кислота расходуется на окислительные процессы, особенно при аэробиозе.
Наши исследования показали, что особенно заметно количество яблочной кислоты убывает при высокой кислотности сусла (на 1,2 г/л), в то время как при низкой кислотности — всего на 0,5 г/л.
Молочная кислота в сусле с меньшей кислотностью появляется в гораздо большем количестве (0,550 г/л), чем в сусле с высокой кислотностью (0,320 г/л). Она образуется при спиртовом брожении из сахара и является побочным продуктом при нормальном алкогольном брожении как в анаэробных, так и аэробных условиях. Молочная кислота может образовываться также и из аминокислот, в частности из аланина, а также при яблочномолочнокислом брожении.
Нами было показано, что вкус вина зависит главным образом от отношения винной кислоты к яблочной. При соотношениях этих кислот около 2 и ниже вино получается негармоничным, с кислым привкусом. Вино с лучшим вкусом и букетом получается при отношении винной кислоты к яблочной 3 и выше. Несколько иные данные были получены М. Амерайном [97]. Он рекомендует собирать виноград при отношении винной кислоты к яблочной от 1,3 до 2,4.
Таблица 18
ИЗМЕНЕНИЕ СОДЕРЖАНИЯ ОРГАНИЧЕСКИХ КИСЛОТ (В Г/Л) В ПРОЦЕССЕ БРОЖЕНИЯ И ФОРМИРОВАНИЯ ВИНА ИЗ ВИНОГРАДА СОРТА АЛИГОТЕ