ПРЕДИСЛОВИЕ
Молдавия — исконный край садоводства и виноградарства. На ее территории в настоящее время разместились 447,5 тыс. га многолетних насаждений, в том числе 194,5 тыс. га садов и 253 тыс. га виноградников.
В два последние десятилетия наряду с дальнейшим расширением площадей основным курсом в развитии садоводства и виноградарства стала всесторонняя интенсификация данных отраслей сельского хозяйства. В связи с этим особое значение придается надежной защите садов и виноградников от вредителей и болезней, среди которых все более важную роль играют вирусные. Постоянные потери урожая, вызываемые хроническими заболеваниями плодовых культур и винограда, заставили плодоводов и виноградарей ряда экономически развитых стран перейти на производство свободного от вирусов посадочного материала.
В Советском Союзе такая задача впервые поставлена и успешно решается в Молдавской ССР. Исследовались состав, распространение, экономическое значение вирусов и микоплазм, поражающих плодовые культуры и виноград в Молдавской ССР, осваивались и испытывались современные методы их диагностики, организованы получение и успешное размножение безвирусного посадочного материала. Почти всю указанную работу провел коллектив отдела вирусологии Молдавского НИИ садоводства, виноградарства и виноделия. В 60-е годы в ней участвовали аспиранты кафедры защиты растений Кишиневского сельскохозяйственного института имени М. В. Фрунзе под руководством профессора Д. Д. Вердеревского.
С 1978 г. изучение вирусов плодовых и ягодных культур и разработку мер борьбы с ними выполняет Молдавский НИИ плодоводства НПО «Кодру», аналогичные исследования по вирусам винограда — Молдавский НИИ виноградарства и виноделия НПО «Виерул». Некоторые фундаментальные и методические исследования по вирусам винограда вирусологи этих институтов выполняют совместно.
Предлагаемая читателю монография содержит основные сведения о вирусных и микоплазменных заболеваниях, поражающих плодовые культуры и виноград в нашей стране и на других территориях, включая данные вирусологов Молдавии.
Авторы надеются, что их монография окажет помощь специалистам, связанным с реализацией обширной программы перевода питомниководства на безвирусную основу, что, в свою очередь, будет способствовать дальнейшему росту урожайности плодовых культур и винограда и успешному выполнению Продовольственной программы страны.
СОВРЕМЕННОЕ СОСТОЯНИЕ ИЗУЧЕННОСТИ ВИРУСНЫХ И МИКОПЛАЗМЕННЫХ ЗАБОЛЕВАНИИ ПЛОДОВЫХ КУЛЬТУР
Вирусные заболевания плодовых культур стали объектом интенсивного изучения в последние 25—30 лет.
К началу 30-х годов было известно лишь пять вирусных заболеваний персика в Северной Америке: болезнь фони (Peach phony. Neal, 1920), розеточность персика (Peach rosette. Smith, 1891), желтуха персика (Peach yellows. Smith, 1888), мелкоплодность персика (Peach little peach. Smith. 1891), красный шов персика (Peach red suture. Bennett, 1926) и одно вирусное заболевание— шарка сливы в Европе (Plum pox. Atanasoff, 1932). По крайней мере четыре перечисленных заболевания (фони, розеточность, желтуха персика, а также шарка сливы) относятся к числу особо опасных. В 1932 г. к ним добавилась мозаика персика (Peach mosaic. Hutchins, 1932).
Распространение этих болезней приводило порой к опустошению. За первые 10 лет эпифитотии в графстве Беррин штата Мичиган площади персиковых садов уменьшились в 12 раз, а в графстве Делавэре того же штата за последующие 30 лет число персиковых деревьев сократилось в 10 раз. В штате Мэриленд с 1890 по 1920 г. персиковые сады сократились с 50 до 5% от общей площади плодовых насаждений. В штате Джорджия до 1929 г. более 1 млн. деревьев раскорчевано вследствие заражения болезнью фони. С 1929 по 1952 г. уничтожено еще около 2 млн. деревьев.
В юго-западных штатах в этот же период от заражения мозаикой погибло около 300 тыс. персиковых деревьев (Каванг, Рот, 1956). В 1939 г. на юге Калифорнии 18 тыс. молодых деревьев персика были поражены этой болезнью (цит. по: Маковей, Николаеску, 1970).
В Европе вирус шарки нанес серьезный ущерб сливоводству ряда стран. К началу 30-х годов в Болгарии насчитывалось 20 тыс. деревьев сливы, пораженных шаркой (Atanasoff, 1932). В Югославии к 1960 г. зарегистрировано не менее 11 млн. больных деревьев (Pobegajlo, 1960).
В Чехословакии широкое распространение вируса шарки наблюдалось с 60-х годов, что привело к снижению продуктивности сливовых насаждений на 85%. Общие потери в стране от вируса шарки оценены в 2 млн. крон (Blattny, Heger, 1965). Проблема шарки в ЧССР усугубляется тем, что сливу здесь традиционно выращивают на сеянцах Ренклода зеленого, а этот сорт в отличие от большинства других на заражение вирусом шарки реагирует некротическим поражением древесины. Поэтому деревья, растущие на таких подвоях, после заражения их шаркой практически не плодоносят и постепенно гибнут.
К сказанному можно добавить, что к 1970 г. число стран, где обнаружен вирус шарки в Европе, увеличилось до 17, соответственно возросли потери, наносимые плодоводству мира этим заболеванием (Kristensen, 1979).
Высокая вредоносность перечисленных выше заболеваний явилась главной причиной того, что их изучению стали уделять серьезное внимание. Экономический фактор был первым и решающим условием последующего прогресса в этой области знаний.
Вторым важным фактором, определившим современные успехи в изучении вирусов плодовых культур, явился быстрый прогресс в развитии общей и частной вирусологии в 60—80-е годы. Этот фактор, в свою очередь, стал результатом стремительного прогресса молекулярной биологии, усовершенствования лабораторной техники, методов исследований и наших знаний о самых сокровенных процессах, протекающих в живой клетке.
Попытаемся коротко проследить развитие наших знаний о вирусных болезнях плодовых культур и их возбудителях на протяжении последних десятилетий.
В 30—50-е годы быстро увеличивается число обнаруженных и описанных вирусных заболеваний на плодовых культурах. Зачастую при этом болезни, вызываемые одним и тем же вирусом у разных плодовых пород, описываются как самостоятельные. Так, вирус некротической кольцевой пятнистости косточковых был описан на персике (Peach ring spot. Cochran, Hutchins, 1941), вишне (Sour cherry necrotic ring spot. Moore, Keitt, 1944), миндале (Almond calico. Thomas, Rawlins, 1951), черешне четырежды (Cherry rugose mosaic. Thomas, Rawlins, 1939; Cherry lace leaf. Zeller, 1942; Cherry tatter leaf. Hildebrandt, 1944; Cherry mild rugose mosaic. Berkeley, 1950).
Многократное «открытие» одних и тех же вирусов в этот период объяснялось отсутствием надежных методов их идентификации. Описание внешних симптомов и установление инфекционности путем заражения прививкой, передачей соком или насекомыми-переносчиками — вот почти и все, чем располагали первые исследователи растительных вирусов.
Между тем мы знаем теперь, что внешние симптомы вирусных заболеваний крайне изменчивы. Различная вирулентность вирусных изолятов, степень восприимчивости поражаемых пород, стадия в развитии болезни и, наконец, влияние климатических и погодных условий — и внешняя картина заболевания неузнаваемо изменится.
Несовершенство методов диагностики явилось одной из главных причин того, что наши знания о вирусах плодовых в этот период в основном расширяются и значительно медленнее углубляются. Важной предпосылкой дальнейшего углубления наших знаний о вирусах плодовых культур стало открытие J. D. Moore, I. S. Boyle, G. W. Keitt (1948), перенесших вирус некротической кольцевой пятнистости вишни на семядоли огурцов.
Возникшие в связи с этим открытием возможности используются в различных направлениях. Исследуется круг восприимчивых травянистых растений-хозяев для непосредственной диагностики сокопереносимых вирусов плодовых. Одновременно идет поиск растений-дифференциаторов, позволяющих различить сходные, но самостоятельные вирусы, и растений-фильтров для выделения отдельных вирусов из смесей. В соке травянистых индикаторов исследуются свойства, позволяющие судить об их термостойкости, концентрации в зараженных тканях, времени сохранения инфекционности in vitro. Метод травянистых индикаторов, разработанный многими талантливыми исследователями, и сейчас находит самое широкое применение как простой и быстрый метод диагностики переносимых соком вирусов плодовых при их изучении и фитосанитарной селекции маточных растений в практике безвирусного питомниководства.
Другим важнейшим результатом открытия J. D. Moore, I. S. Boyle, G. W. Keitt стало то, что перенесенные на травянистые индикаторы вирусы плодовых стали, наконец, доступными для очистки, концентрирования и глубокого изучения их иммунологических особенностей, биохимических свойств, морфологии и ультраструктуры.
Очистка вирусов непосредственно в соке пораженных ими плодовых растений сопряжена с большими трудностями.
Во-первых, изолирование вирусов в соке плодовых связано с высокой активностью окислительных ферментов. Многие авторы отмечали быстрое побурение тканей и соков зараженных вирусами растений, связанное с интенсивной деятельностью полифенолоксидазы и накоплением продуктов окисления фенолов (Diener, 1963; Rubin, Artihovskaja, 1964). У плодовых растений обмен фенолов вообще интенсивен, а при заражении вирусами — особенно. В результате интенсивной деятельности полифенолоксидазы в тканях плодовых накапливаются полифенолы в виде гидролизованного или конденсированного танина и продукты дальнейшего окисления полифенолов хиноны. В момент растирания тканей плодовых для извлечения сока танины и хиноны соединяются с вирусами, образуя нерастворимые комплексы. При этом вирусы либо выпадают в осадок и теряются на первых этапах очистки, либо вообще инактивируются при соединении с хинонами (Bawden, 1954; Hampton, Fulton, 1961).
Во-вторых, большим препятствием для очистки вирусов непосредственно из плодовых является высокая кислотность их соков (Cadman, 1960). Кроме того, сок из листьев многих плодовых содержит значительное количество гидрофильных коллоидов пентозного типа, поэтому он густой и слизистый, что мешает нормальному протеканию процессов очистки.
В дополнение ко всем перечисленным недостаткам ткани плодовых, как правило, очень бедны вирусами. Даже в растениях с ярко выраженными симптомами заражения концентрация вирусов ничтожна, и распределены они в тканях весьма неравномерно.
И, наконец, последнее. У плодовых очень распространены различные вирусные комплексы, поэтому получить из них очищенные препараты какого-либо одного вируса очень трудно. Сложная и многолетняя работа группы канадских исследователей по серологическому изучению вирусов кольцевых пятнистостей косточковых оказалась неудачной из-за того, что в антигене, приготовленном из лепестков вишни, присутствовали два независимых вируса — некротической кольцевой пятнистости косточковых и карликовости сливы, что привело авторов к ошибочным выводам об идентичности названных вирусов (Willison. Weintraub, Tremaine, 1959; Tremaine, Willison, 1961, 1962; Tremaine, Allen, Willison, 1964; Allen. Tremaine, 1965).
Многие из перечисленных трудностей можно преодолеть, перенося вирусы с плодовых на травянистые растения, а затем подвергнув их очистке в соке последних. Так, перенос на семядоли огурцов вирусов кольцевых пятнистостей косточковых (Moore, Boyle, Keitt, 1948) позволил очистить их для целей электронной микроскопии и серологии (Fulton. 1959) и далее установить независимость вирусов некротической кольцевой пятнистости и карликовости сливы (Fulton, Hamilton, 1960). Перенос арабис-мозаики на огурцы и Petunia hybrida способствовал очистке этого вируса (Cadman, 1960; Hollings, 1963), изолирование вируса скручивания листьев вишни на Chenopodium quinoa u Nicotiana tabacum позволило получить очищенный препарат и диагностические сыворотки (Cropley, 1961; Tomlinson, Walkey, 1967).
Основным условием очистки ряда нитевидных вирусов плодовых также явился перенос их на травянистые тест-растения: шарки — на Chenopodium foetidum и Nicotiana clevelandii, в соке которых они были очищены (Kegler, Schmidt, Trifonow, 1964; Kassanis, Sutic, 1965), хлоротической пятнистости листьев яблони и темно-зеленых эпинастий — на Ch. quinoa (Lister, Bancroft, Nadakavukaren, 1965; Sequeira, Croplev, 1968; Saksena, Mink, 1969).
Итак, перенос вирусов, поражающих плодовые культуры, на травянистые индикаторы всегда был необходимым этапом на пути их точной идентификации и дальнейшего, более глубокого изучения. Но осуществить это. как правило, тоже достаточно трудно. На пути успешного переноса вирусов из тканей плодовых культур на травянистые растения вставали те же препятствия, которые мешали очистке вирусов в соке плодовых: окислительная активность ферментов, в особенности полифенолоксидазы, танины, хиноны, кислотность сока, низкая концентрация вируса в тканях плодовых. Необходимо было защитить вирус от действия всех этих неблагоприятных факторов, стабилизировать его хотя бы на короткое время в соке плодовых. Для защиты вирусов от быстрой инактивации в момент растирания тканей плодовых предложено много различных стабилизирующих веществ. Чаще других применяют следующие: ДИЕКА (диэтилдитиокарбамат натрия), который инактивирует фермент полифенолоксидазу, блокируя в ней ион меди (Hampton, Fulton, 1961), никотин-сульфат (Thung, 1951) или никотин-основание (Kirkpatrick, Cheney, Lindner, 1964), кофеин (Diener, Weaver, 1959). Эти вещества освобождают вирусы из комплексов вирус-танин. Тиогликолят натрия, 2-меркапто- этанол (Fulton, 1965), ЕДТА (этилендиаминтетраацетат натрия) защищают вирусы от необратимого ингибирования хинонами. Для связывания фенольных компонентов в последние годы используют поливинилпирролидон М—10000 (PVP—10) в концентрации 2—5% и полиэтиленгликоль М—6000 концентрацией 1—4% (Fulton, 1976; Casper, 1976). Кроме перечисленных применяют многие другие вещества: тиомочевину, сульфит натрия, аскорбиновую кислоту, активированный уголь, бентонит.
Для уменьшения кислотности среды и защиты вирусов в процессе переноса на травянистые растения используют буферные растворы. Чаще других для этого берут фосфатный 0,1—0,3 М или трис-буфер со значением pH, близким к 8. В последние годы некоторые исследователи успешно использовали гепес-буфер (Casper, 1976).
Концентрацию вируса в инокулюме повышают одним циклом препаративного ультрацентрифугирования.
В различные годы проведены специальные исследования многих факторов, влияющих на успешность переноса вирусов от плодовых культур на травянистые индикаторы и последующие процедуры очистки их в соке последних. Первые такие эксперименты с вирусами кольцевых пятнистостей проведены R. W. Fulton (1959, 1962), показавшим влияние pH буфера, молярности экстрагирующих растворов, температуры, степени разведения вирусов в инокулюме. Перенос на травянистые растения-хозяева и последующая очистка каждого нового, в особенности нестойкого, вируса обязательно требовали большой подготовительной работы. Действуя на первых порах сугубо эмпирически, исследователи постепенно накапливали знания об общих особенностях, присущих целым группам вирусов (НЕПО-вирусам, ИЛАР-вирусам, ПОТИ- вирусам, включая шарку, КЛОСТЕРО-вирусам, широко поражающим яблоню и косточковые культуры). Специальные методические исследования оптимальных условий изолирования вирусов из Специальные методические исследования оптимальных условий изолирования вирусов из тканей плодовых на травянистые растения с последующей очисткой их выполнены в ГДР (Opel, Kegler, 1968).
После переноса вируса на какое-либо травянистое растение, чаще из семейства Cucurbitaceae или Chenopodiaceae, изучался круг восприимчивых растений-хозяев, выделялись растения с системной реакцией, дающие наибольшее накопление вируса, и растения с местной некротической реакцией, позволяющие быстро устанавливать присутствие вируса и его концентрацию в исследуемых тканях.
Эта последовательность в изучении вирусов плодовых (перенос на травянистые растения, определение свойств вирусов в соке, очистка и изучение их морфологии, структуры, химического состава и иммунологических особенностей) казалась незыблемой и была весьма плодотворной. Таким образом исследовано 24 вируса, изолированных из тканей плодовых, с составлением полных или частичных криптограмм. И хотя число перенесенных на травянистые индикаторы и изученных вирусов плодовых все-таки было меньше, чем количество заболеваний, возбудителей которых, несмотря на упорные усилия многих исследователей, не удавалось изолировать и исследовать, основное направление работ казалось бесспорным.
Выражая общее мнение, профессор М. Клинковский на VII симпозиуме по вирусным заболеваниям плодовых культур высказал убеждение, что принципиально возможен механический перенос любого вируса, если удастся исключить действие ингибитора (Klinkowski, 1968). Сегодня, в свете новых данных о растительных микоплазмах-возбудителях болезней типа желтух, у нас нет уже этой уверенности.
Y. Doi, М. Teranaka, К. Yora, H. Asuyama (1967) во флоэме растений, пораженных заболеваниями типа желтух, обнаружили специфические микоплазмоподобные тельца. В последующие годы микоплазмоподобные организмы описаны как возбудители 131 заболевания растений, среди которых болезни плодовых культур: мелкоплодность яблони (Apple chat fruit), гуттаперчевость древесины яблони (Apple rubbery wood), пролиферация яблони (Apple witshes’ broom), истощение груши (Pear decline), мелкоплодность черешни (Little cherry), Х-болезнь персика (Peach X-disease), Х-болезнь вишни и черешни (Western X-little cherry), хлоротическое скручивание листьев абрикоса (Apricot chlorotic leaf roll), задержка роста айвы (Quince stunt) и отмирание коры айвы (Quince bark necrosis. Kegler, 1977), отмирание японской сливы (Japanese plum-tree decline. Giunchedi, Poggi-Pollini, Credi, 1982).
Очевидно, в ближайшие годы многие другие, ранее известные как вирусные непереносимые соком заболевания, будут отнесены к микоплазмам—сппроплазмам (болезнь дубоплодности цитрусовых— Citrus stubborn disease), бактериям (болезнь фони персика — Phony peach) или вироидам. Среди непереносимых соком вирусных заболеваний установлены и вироиды, первыми из которых стали болезни, поражающие плоды яблони — рубцеватость (Apple scar skin),пятнистость плодов (Apple dapple). Вироидная природа этих заболеваний установлена японскими исследователями (Koganezawa, Yanase, Sakuma, 1982). Одновременно показаны родство или идентичность возбудителей и их независимость от другого заболевания со сходным поражением плодов, известного как зеленая морщинистость (Apple green crinkle).
Специфическая двойная РНК изолирована из тканей черешни, пораженной болезнью мелкоплодности (Hamilton, Dodds, Raine, 1980) и некротической ржавой крапчатостью черешни (Moore, Cameron, 1982). Однако в этих случаях окончательные выводы о природе названных заболеваний еще не сделаны.
Нет сомнения также, что в результате применения более совершенной техники переноса некоторые из непереносимых сегодня соком заболеваний будут перенесены на травянистые индикаторы, а затем изолированы и всесторонне изучены.
В последние годы создание высокочувствительных и точных методов серологической диагностики растительных вирусов — ELISA-теста (Clark, Adams 1977) и иммуноэлектронной микроскопии (Milne, 1980) — открыло новые возможности для более глубокого изучения вирусов плодовых культур. Так, разработаны очень чувствительные методы тестирования плодовых в рамках санитарной селекции (Clark, Adams, Barbara, 1976; Casper, 1977; Fuchs, 1980; McMorran, Cameron, 1983), получены новые данные о взаимосвязи вирусов ИЛАР-группы (Barbara, Clark. Thesh, Casper, 1978), о штаммах вируса ХПЛ (Detienne, Delbos, Dunez, 1980), семенной инфекции вируса шарки (Nemeth, Kobler, 1982) и др.
Сейчас ведутся интенсивные исследования по изучению взаимоотношений между возбудителями отдельных вирусных заболеваний, а также выделенными в процессе их изучения вирусами. Прежде всего такие исследования были проведены с нематодопереносимыми сферическими вирусами, названными НЕПО-вирусами (Cadman, 1960; Harrison, Murant, 1977), и с вирусами, вызывающими симптомы кольцевых пятнистостей у большинства косточковых, что позволило объединить их в группу ИЛАР-вирусов (Fulton, 1968). В последующие годы вирус шарки нашел свое место в группе ПОТИ-вирусов, вирус хлоротической пятнистости листьев яблони — в группе КЛОСТЕРО-вирусов, а вирус бороздчатости древесины выделен в отдельную группу. Очевидно, такие исследования позволят в дальнейшем составить научную систематику, основанную на знании истинных филогенетических связей между вирусами плодовых культур.
Теперь вернемся немного назад, рассмотрим состояние изученности путей распространения вирусов и микоплазм, поражающих плодовые культуры. Для большинства их известен единственный способ распространения — вегетативный, в процессе прививки и окулировки черенками, глазками и отводками от зараженных материнских растений. Причем именно этот путь, тесно связанный с вегетативным способом размножения плодовых культур, привел к массовому распространению вирусных инфекций и заражению ими большинства современных промышленных сортов.
Факторы, способствующие распространению вирусных и микоплазменных инфекций вегетативным путем, следующие: полная маскировка внешних симптомов у зараженных растений в отдельные годы, частичная маскировка симптомов под воздействием высоких температур в летний период, что приводит к внешнему оздоровлению маточных растений как раз к моменту заготовки черенков (июль—август), отсутствие внешнего проявления заражения у относительно устойчивых или толерантных сортов плодовых, наличие латентных вирусов, обнаруживающих свое присутствие только при заражении особо восприимчивых сортов и видов плодовых культур.
Среди прочих причин массового распространения вирусов немалую роль сыграло применение вегетативных подвоев. Если при использовании сеянцевых подвоев мы в качестве источника вирусного или микоплазменного заражения имели только привой (семенами плодовых культур большинство вирусов передается незначительно или совсем не передается), то с помощью вегетативных подвоев мы удвоили опасность получения зараженного потомства, одновременно увеличилась опасность образования вирусного комплекса более вредоносного, чем отдельные составляющие его вирусы и микоплазмы.
Убедительный аргумент в пользу того, что заражение в процессе вегетативного размножения является основным путем распространения вирусных и микоплазменных заболеваний плодовых культур, получили английские исследователи. Они тестировали 200 маточных деревьев черешни и установили, что степень заражения зависит не от возраста деревьев, а от возраста сортов: старые сорта, введенные в культуру до 1920 г., были поражены хотя бы одним вирусом на 91%, а новые — только на 39% (Posriette, Cropley, Swait, 1968). И это у черешни, на которой многие вирусные заболевания, как установлено, естественно распространяются в саду насекомыми-опылителями и передаются семенами. У яблони, где для большинства вирусов и микоплазм вторичное распространение отсутствует или ничтожно мало, новые гибридные сорта полностью свободны от вирусных инфекций (Nemeth, 1966; Бивол, 1978).
Однако некоторые из вирусных и микоплазменных заболеваний плодовых помимо основного пути передачи с зараженным посадочным материалом способны естественно распространяться в природе при помощи различных насекомых, нематод и клещей.
Цикады переносят следующие заболевания плодовых, возбудителями которых, по последним данным, являются растительные микоплазмы: мелкоплодность персика (Lillte peach), желтуху персика (Peach yellows) —цикада Macropsis trimaculata (Fitch); болезнь фони (Phony peach) —Cuerna costalis (F.), Graphocephala versuta (Say.), Homalodisca coagulata (Say.), H. insolita (Walk), Х-болезнь персика (Peach X-disease)—цикады Colladonus geminatus (Van Duzee), C. montanus, Euscelidius variegatus (Kirschb.), Fieberiella flori (StaL), Gyponana striata (Burm.), Keonolla confluens (UbL), Osborneleus borealis (De Long et Mohr.), Scaphytopius acutus (Say.); западную Х-болезнь персика— цикады Colladonus clitellarius (Say.), Fieberiella flori (StaL), Gyponana lamina (De Long.), Norvellina seminuda (Say.), Paraphlepsius irroratus (Say.), Scaphytopius acutus (Say.); мелкоплодность черешни и вишни (Little cherry) и Х-болезнь черешни и вишни (Western X-little cherry)—цикады Macrosteles fascifrons (StaL), Scaphytopius acutus (Say.), Psammotettix lividellus (Zett.). В Советском Союзе из перечисленных заболеваний обнаружены желтуха персика (Peach yellows), выявленная и исследованная в 1940—1941 гг. в Туркменской ССР Д. Д. Вердеревским, мелкоплодность и Х-болезнь черешни и вишни (Little cherry; Western X-little cherry) (Вердеревская, 1973).
Медяницы Psylla piricola (Forster), P. piri и P. pirisuga распространяют болезнь истощения груши (Pear decline), возбудителем которой также является микоплазма. Тли переносят одно из наиболее вредоносных заболеваний сливы — шарку. В качестве переносчиков на сегодня описаны следующие виды: Aphis craccivora (Koch.), A. spiraecola (Patch), Brachycaudus helichrysi (Kalt.), B. cardui (L.), Myzus persicac (Sulz.), Phorodon humuli- (Schrank). Переносчиком вируса мозаики персика является Erio- phyes insidiosus (Keifer, Wilson) и латентного вируса сливы — клещик Aculus fockeui (Nal et Trones).
Наиболее исследована среди переносчиков вирусов плодовых культур роль нематод в распространении соответствующей группы вирусов.
На плодовых в настоящее время идентифицированы заболевания, вызываемые шестью НЕПО-вирусами. Переносчиками их являются крупные свободно живущие нематоды из семейства Dorilaimidae подсемейства Tylenchoitninae двух родов — Longidorus и Xiphinema. Так, вирус кольцевой пятнистости малины (Raspberry ring spot virus) в комплексе с вирусом карликовости сливы вызывающий заболевание рашпилевидности листьев черешни (Pfefinger disease), Eckelrader disease), в Англии распространяет нематода Longidorus elongatus (De Man, Thorne et Swanger) (Taylor. 1962). Сходное заболевание может вызвать также вирус арабис-мозаики (Arabis mosaic virus), переносчиком которого является нематода Xiphinema diversicaudatum (Mico- letzky, Thorne) (Jha, Posnette, 1961). Вирус скручивания листьев черешни (Cherry leaf roll virus) распространяют нематоды Xiphinema diversicaudatum (Micoletzky, Thorne) и X. coxi (Tarjan) (Fritsche, Kegler, 1968; Flegg, 1969). Вирус кольцевой пятнистости томатов (Tomato ring spot virus), штамм пожелтения почек персика и штамм ямчатости древесины косточковых переносит нематода Xiphinema americanum (Cobb.) (Breece, Hart, 1959; Civerolo, Mircetich, 1972) и X. rivesi (Dalmasso) (Forer, Hill, Powell, 1981), латентный вирус кольцевой пятнистости земляники (Strawberry latent ring spot virus), широко распространенный на плодовых,— нематода Xiphinema diversicaudatum (Lister, 1964). В сочетании с вирусом карликовости сливы этот вирус вызывает симптомы рашпилевидности листьев и отмирание деревьев черешни в Италии (Ragozzino, D’Errico, De Vincentiis. 1982).
Безусловно, приведенные данные не исчерпывают действительную роль насекомых в распространении вирусных и микоплазменных заболеваний, и вскоре, очевидно, удастся установить переносчиков таких естественно распространяющихся в саду заболеваний, как пролиферация яблони (Apple witches’ broom), хлоротическое скручивание листьев абрикоса (Apricot chlorotic leaf roll).
Помимо названных путей распространения вирусные заболевания плодовых могут переноситься пыльцой и передаваться семенами. При этом в роли неспецифических переносчиков вирусов способны выступать насекомые-опылители.
Достаточно полно исследована способность распространяться пыльцой и передаваться семенами двух вирусов ИЛАР-группы: некротической кольцевой пятнистости косточковых и карликовости сливы. Эффективность передачи этих вирусов семенами зависит от ряда факторов:
плодовой породы: у вишни магалебской и у черешни семенная инфекция может достигать 70—80% (Megahed, Moore, 1967), у алычи — десятые доли процента;
в пределах одной породы процент семенной инфекции—от восприимчивости сортов;
на одних и тех же сортах — от штамма вируса и возраста зараженного дерева (Schimanski, 1970).
В экспериментах установлено, что все вирусы НЕПО-группы передаются семенами травянистых хозяев, причем семенная инфекция колеблется от 0,6 до 100%. Передача семенами показана при заражении земляники и малины следующими НЕПО-вирусами: черной кольцевой пятнистости томатов (Tomato black ring virus) (Lister, Murant, 1967), кольцевой пятнистости томатов (Tomato ring spot virus) (Kahn, 1956; Mellor, Stace-Smith, 1963) и кольцевой пятнистости малины (Raspberry ring spot virus) (Lister, Murant, 1967). Однако передачу пыльцой названных вирусов плодовых культур установить не удалось. Исключение составил вирус скручивания листьев черешни (Cherry leaf roll virus)— штамм, вызывающий мозаику вяза (Elm mosaic virus), который был передан при помощи пыльцы семенам, однако материнское растение при этом не инфицировалось (Callahan, 1957; цит. по: Cropley, 1971). Инфекция вируса табачной мозаики установлена в семенах яблони при тестировании на травянистых индикаторах (Gilmer, Wilks, 1967). Применение высокочувствительного ELISA-метода серодиагностики позволило обнаружить вирус шарки в косточках абрикоса, персика и сливы и определить процент инфицирования саженцев, выросших из этих семян (Nemeth, Kobler. 1982).
В 1967 г. в Ашерслебене (ГДР) на VII симпозиуме председатель Европейского комитета по кооперации в изучении вирусных заболеваний плодовых деревьев доктор A. Posnette в генеральном докладе отметил, что успехи в разработке методов борьбы или, точнее, методов освобождения зараженных растений от вирусных инфекций заметно опережают наши знания о природе их возбудителей и механизме терапии. Очень мало зная о природе многих весьма вредоносных заболеваний плодовых, мы тем не менее умеем, применяя методы термотерапии, получать исходные растения, свободные от любого из этих заболеваний (Posnette, 1968). За прошедшие годы положение существенно не изменилось.
Имеется несколько методов термической терапии растений от вирусных и микоплазменных заболеваний, которые, прежде всего, можно подразделить на водные и воздушные способы обработки.
Сущность водной терапии заключается в погружении целых растений или отдельных частей их в виде черенков, отводков и усов в воду, прогретую до температуры 35—60°С, на различные периоды времени — от нескольких минут до нескольких суток. Температура воды и длительность обработки в каждом отдельном случае зависят от термостойкости обрабатываемого материала, заражающих его вирусов и микоплазмы.
Впервые водная обработка была использована L. Kunkel для излечивания персика от вирусов мелкоплодности, болезни красного шва, розеточности и желтухи. Черенки зараженных растений он помещал в воду, прогретую до 50°С, на 3—10 мин (Kunkel, 1936). Позже методом водной терапии были инактивированы в черенках и даже целых растениях следующие вирусы и микоплазмы: болезнь фони персика (Hutchins, Rue, 1939), западная Х-болезнь персика (Hildebrandt, 1951), хлоротическое скручивание листьев персика (Nichols, Nyland, 1952), ржавая некротическая пятнистость черешни (Nyland, 1959) и некоторые другие.
В настоящее время метод воздушной термообработки является наиболее изученным и применяемым в практике для получения безвирусных клонов всех плодовых культур.
Наиболее простой метод воздушной обработки мало отличается от водной обработки: покоящиеся растения или их части помещают в термостаты с регулируемой температурой порядка 35—80°С. Длительность обработки и температура в каждом конкретном случае зависят от термостойкости обрабатываемого растения и поражающих его вирусов. Методом воздушной обработки покоящихся черенков A. Christoff (1958) инактивировал такие вирусы плодовых, как шарка, карликовость сливы, некротическая пятнистость листьев вишни, мозаика яблони, каменистость плодов груши, Н. Kegler (1959) этим методом провел термотерапию мозаики яблони и кольцевой мозаики груши, Η. Е. Thomas (1937)—мозаики яблони. Несмотря на простоту, методы водной и воздушной обработки покоящихся черенков не всегда давали ожидаемый терапевтический эффект.
В последующие годы наибольшее распространение получил метод воздушной обработки вегетирующих растений. При этом ст вирусных инфекций освобождается, как правило, не все обрабатываемое растение, а только верхушки стеблей и некоторые почки, отросшие и образованные в период содержания растений в условиях повышенных температур. В 1957—1977 гг. в разработке указанного метода принимали участие ученые разных стран: G. Nyland, A. Posnette. A. Campbell, G. Majorana, G. Martelli, H. Kegler, C. Marenaud, G. Schmid, R. Cropley, Ц. Блаттны, M. Янечкова, Б. Зимандл, H. Миною и др.
В настоящее время методы термотерапии, применяемые в практике получения безвирусных клонов в научных центрах разных стран, основаны на одних и тех же принципах и отличаются скорее деталями и особенностями в конструкциях термокамер. Однако классические методы термотерапии не оправдывают себя при работе с косточковыми культурами. Поэтому были предприняты дальнейшие усилия по усовершенствованию методов терапии косточковых от основных вирусов. Некоторые авторы получили хорошие результаты, используя разработанные ими методы микропрививок (Colin, Verhoyen, 1976; Ikin, 1976) или сочетая методы термотерапии и культуры тканей (Jacob, 1974), микропрививок и культуры тканей (Martinez, Hugard, Jonard, 1979; Navarro, Llacer, Cambra et al., 1982). Сегодня все эти микрометоды, возникшие из-за необходимости освободить косточковые породы от комплекса вирусов, уже определенно воздействуют на классические способы термотерапии семечковых плодовых культур. Главное их достоинство — в удешевлении и ускорении процедуры освобождения растений от вирусов. Поэтому исследования продолжаются, и можно ожидать в скором времени значительного видоизменения традиционных методов терапии плодовых культур от вирусов и микоплазм.
Единые требования к чистоте плодовых растений от вирусов и микоплазм и унификация методов контроля облегчили обмен безвирусным материалом как внутри страны, так и в международном масштабе, а большая трудоемкость получения каждого безвирусного сорта сделала такой обмен необходимым. Важную роль в налаживании обмена исходным материалом сыграл Европейский комитет по кооперации в изучении вирусных заболеваний плодовых деревьев (ЕККИВП). Однако налаживание обмена безвирусным посадочным материалом между исследователями разных стран — это только одна сторона деятельности комитета.
Образованный в начале 50-х годов по инициативе нескольких ведущих вирусологов ЕККИВП провел большую работу по интенсификации исследований вирусных заболеваний плодовых культур в разных странах Европы, стандартизации методик, обмену необходимой информацией и материалами (семенами, индикаторами, сыворотками). По инициативе комитета регулярно, начиная с 1954 г., проводятся европейские симпозиумы по проблеме изучения вирусов плодовых. В 1973 г. на IX симпозиуме комитет был переименован в Международный комитет по кооперации в изучении вирусов плодовых культур (International Committee for Cooperation in Fruit Tree Virus Research) и вошел как рабочая группа в Международное общество по плодоводству (International Society for Horticultural Sciens).
Систематическое обобщение всего нового в изучении вирусов плодовых и разработка мер борьбы с ними, проводимые на каждом очередном симпозиуме, дискуссии по спорным вопросам, личные контакты ученых из разных стран — все это способствует общему прогрессу наших знаний о вирусах плодовых.
Начиная с 1973 г. большая и полезная работа по объединению усилий ученых-вирусологов стран социалистического лагеря выполнена в рамках Постоянной комиссии по сельскому хозяйству стран — членов СЭВ. Проведена унификация методик, ведется интенсивный обмен исходным безвирусным материалом, создана коллекция безвирусных клонов лучших современных сортов и подвоев стран СЭВ (в совхозе «Нистру» НПО «Кодру» МССР). В 1976 г. была утверждена тема 6.8 сотрудничества стран—членов СЭВ в получении безвирусных клопов и изучении устойчивости плодовых культур к важнейшим вирусам и микоплазмам. В рамках этого сотрудничества проведено четыре совещания: в Кишиневе (1975 г.), Ашерслебене (1976 г.), Софии (1978 г.) и Градец Кралове (1980 г.). На рабочих совещаниях кроме обмена новейшей информацией разработана программа получения безвирусных клонов основных современных сортов, оценены возможности и утверждены методы оценки плодовых культур на устойчивость к вирусам и микоплазмам, что стимулировало соответствующие исследования.
Заканчивая краткий обзор состояния изученности вирусных заболеваний плодовых культур, нам представлялось важным определить место возбудителей рассмотренных заболеваний в общей системе фитопатогенных вирусов. Однако решение этой задачи даже в умеренном объеме оказалось невозможным из-за недостаточной изученности возбудителей большинства описанных заболеваний плодовых культур. Недостаток информации о природе вирусов, изолированных из плодовых, стал причиной того, что только четыре группы: НЕПО-вирусы, ИЛАР-вирусы, ПОТИ-вирусы и КЛОСТЕРО-вирусы — нашли свое место среди описанных 30 групп растительных вирусов, не считая такие широко специализированные вирусы, как вирус табачной мозаики, вирус огуречной мозаики, вирусы некроза табака, кустистой карликовости томатов и некоторые другие, патогенное действие которых на плодовые растения не установлено.
Таблица 1
Вирусы, изолированные из плодовых культур, и заболевания, которые они вызывают
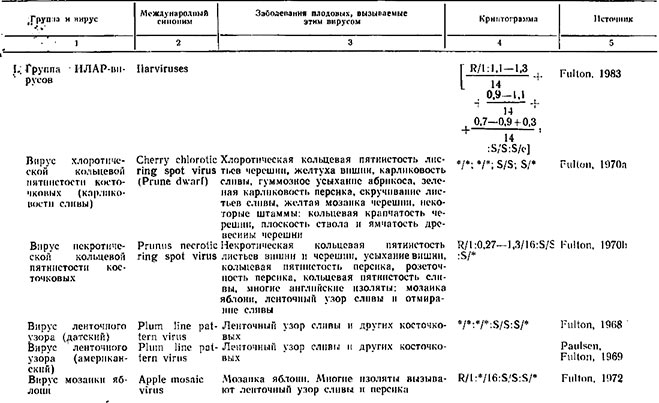



Таблица 2.
Вирусные заболевания плодовых культур, возбудители которых не изолированы или ими являются микоплазмы и вироиды

Продолжение табл. 2

Пока создание естественной классификации вирусов плодовых культур не представляется возможным. Мы ограничились составлением двух таблиц, в которых суммированы имеющиеся на сегодня данные о переносимых соком вирусах, изолированных плодовых растений, и заболеваниях, возбудителей которых удалось изолировать или ими оказались растительные микоплазмы и вироиды (табл. 1,2).
Недостаточная изученность вирусных заболеваний плодовых культур и невозможность применить единый принцип их классификации очень затруднили нам изложение основного содержания настоящей работы. Опираясь на уровень изученности вирусных и микоплазменных заболеваний, рассматриваемых в данной работе, мы применили два принципа их систематизации. Там, где родственные связи исследованы, использован принцип их международной классификации. В случае, когда возбудители не выделены или ими являются микоплазмы и вироиды, взаимоотношения между которыми изучены совершенно недостаточно, придерживались формального принципа: поражаемая культура и характер симптомов, приуроченных к определенным органам больного растения.

