α-Дикетоны и оксикетоны в вине
Многие исследователи занимались: биосинтезом 2,3-бутандиона (диацетила) и 3-окси-2-бутандиона (ацетоина) при спиртовом и молочнокислом брожении.
Первые исследования были проведены К. Нейбергом и Е. Реинфуртом в 1923 г., которые показали, что ацетоин образуется во второй фазе спиртового брожения в результате конденсации двух молекул уксусного альдегида:
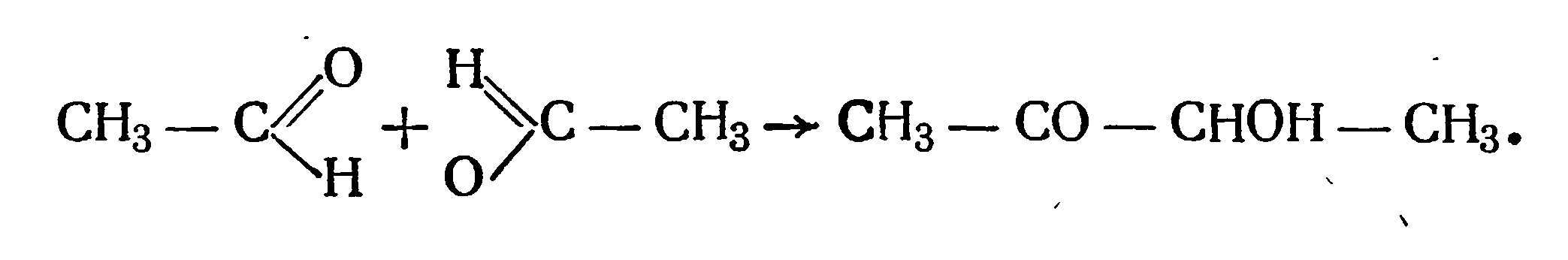
Эта реакция получила название ацетоиновой конденсации двух уксусных альдегидов.
Другие авторы считают, что ацетоин продуцируют микроорганизмы путем конденсации двух молекул пировиноградной кислоты:
![]()
Более детально механизм образования ацетоина и диацетила был изучен лишь в последние 15—20 лет. Наиболее подробно был рассмотрен биосинтез ацетоина и диацетила дрожжей и молочнокислых бактерий.
В настоящее время считают, что ацетоин и диацетил, образуются из ацетомолочной кислоты.
Биосинтез ацетомолочной кислоты
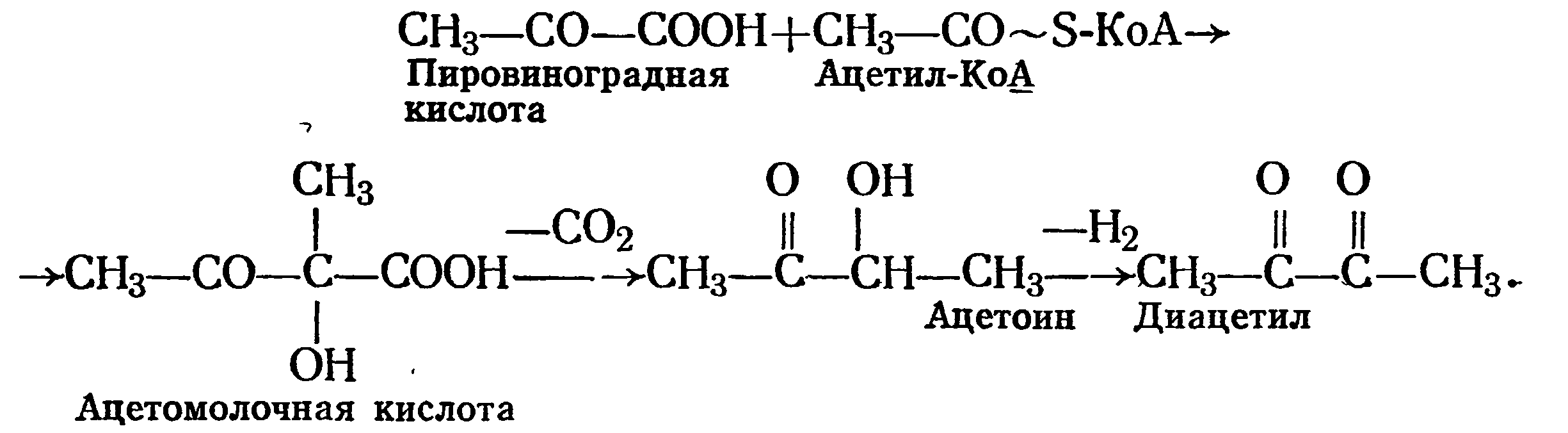
Большинство исследований по изучению путей ферментативного синтеза ацетоина и диацетила позволяют придти к следующей общей схеме образования этих соединений микроорганизмами:

Как видно из схемы, исходными продуктами для синтеза ацетоина и диацетила являются пировиноградная кислота и тиамин- пирофосфат (*ТРР), при конденсации которых образуется α-ацетомолочная кислота. Последняя является предшественником ацетоина и диацетила.
Для биосинтеза ацетомолочной кислоты необходимы две молекулы пировиноградной кислоты, из одной образуется оксиэтилтиа- минпирофосфат, а также ионы Мn2+ или Mg2+. Ферментативный механизм образования ацетомолочной кислоты следующий: вначале действием пируватдекарбоксилазы пировиноградная кислота превращается в оксиэтилтиаминпирофосфат, который под действием фермента α-ацетолактатсинтетазы образует с другой молекулой пировиноградной кислоты ацетомолочную кислоту. Последняя под действием фермента ацетолактатдекарбоксилазы декарбоксилируется в ацетоин [119].
Ацетомолочная кислота участвует в биосинтезе аминокислот, в частности валина, который оказывает ингибирующее действие на образование ацетомолочной кислоты и диацетила [106]. В данном случае валин, видимо, является аллостерическим регулятором синтеза ацетомолочной кислоты и действует как ингибитор по принципу обратной связи на α-ацетолактатсинтетазу [54].
Имеется ряд работ, указывающих и на другой путь биосинтеза диацетила и ацетоина дрожжами, не связанный с образованием ацетомолочной кислоты, по схеме:

Из схемы видно, что в начале синтеза из пировиноградной кислоты образуется оксиэтилтиаминпирофосфат, который с новой молекулой уксусного альдегида образует комплекс энзимацетоинтиаминпирофосфат, превращающийся затем в ацетоин. Последний, дегидрируясь, дает диацетил.
Отличительной чертой в этом синтезе является то, что не сама пировиноградная кислота реагирует с оксиэтилтиаминпирофосфа- том, а последний с новой молекулой уксусного альдегида образует ацетоин. Эта реакция аналогична реакции ацетоиновой конденсации двух молекул уксусных альдегидов. В этой реакции К. Нейберг рассматривал процесс декарбоксилирования также связанным: с образованием комплекса фермент — уксусный альдегид, который затем переносится на свободный уксусный альдегид, образуя в результате ацетоин.
Существует и другой путь биосинтеза диацетила, заключающийся в том, что дрожжи в присутствии НАД+ превращают одну молекулу пировиноградной кислоты в ацетил-КоА. Затем ацетил- КоА конденсируется с другой молекулой пировиноградной кислоты, образуя ацетомолочную кислоту, с последующим декарбоксилированием ее в ацетоин по схеме:
Рассматривая схемы биосинтеза ацетоина и диацетила можно считать, что наиболее правдоподобной является схема конденсации оксиэтилтиаминпирофосфата со свободным уксусным альдегидом с образованием энзимацетоин-ТРР-комплекса и распадом этого комплекса в ацетоин. Эта схема имеет место при алкогольном брожении, когда образуется значительное количество; уксусного альдегида при декарбоксилировании пировиноградной кислоты.
Если ацетоин и диацетил образовывались бы из ацетомолочной кислоты, то валин должен был бы ингибировать их образование, так как эти соединения появляются на пути его синтеза. Как показали наши исследования [79], валин почти не ингибирует образования диацетила и ацетоина при алкогольном брожении.
Многие исследователи считают, что диацетил образуется из ацетоина, который является промежуточным продуктом. Ацетоин в присутствии ацетоиндегидрогеназы и НАД+ превращается в диацетил по схеме
Однако диацетил легко восстанавливается в ацетоин под действием диацетилредуктазы в присутствии НАД-Н2 по схеме
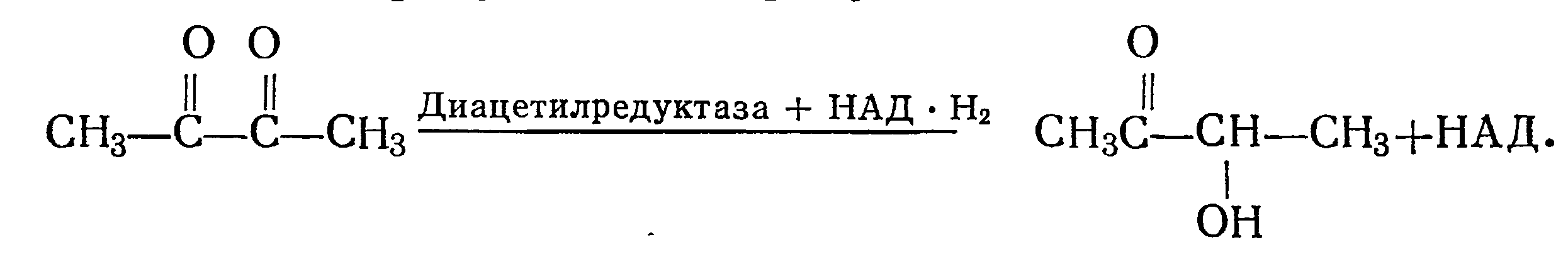
До недавнего времени существовало мнение, что дйацетилредуктаза содержится только в бактериях [100]. Недавно нами совместно с А. В. Кавадзе [42] было показано, что диацетилредуктаза содержится и у винных дрожжей. Этот фермент участвует в восстановлении диацетила в ацетоин при дображивании виноматериалов и получении неокисленных вин.
Ацетоин в присутствии бутиленгликольдегидрогеназы и НАД-Н2 восстанавливается в 2-3-бутиленгликоль по схеме
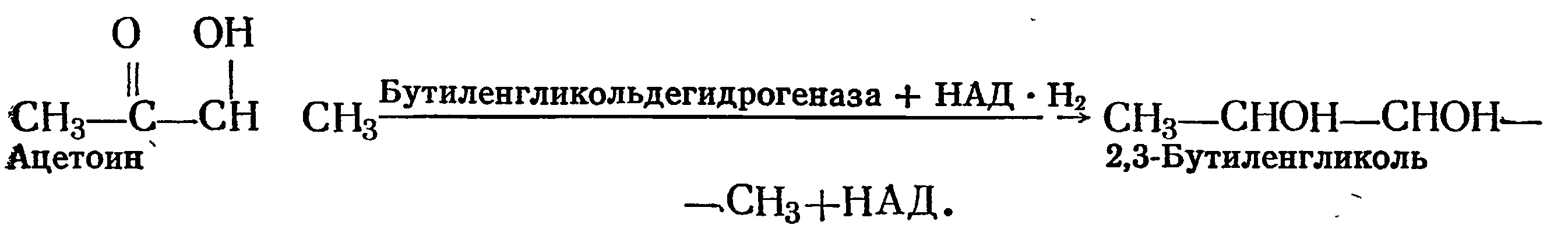
Эти соединения образуют в биологических средах, в частности в винах, окислительно-восстановительную систему:

В зависимости от активности действующих в этой системе ферментов превалируют те или иные продукты его превращения. По данным А. С. Вечера и Л. А. Юрченко [17], если в вине превалируют восстановительные процессы, то накапливается 2,3-бутиленгликоль. Наоборот, в аэробных условиях окислительные процессы усиливаются и в вине увеличивается количество уксусного альдегида, диацетила и этилацетата, что приводит к ухудшению качества вина.
Таблица 14
СОДЕРЖАНИЕ ДИКЕТОНОВ (В МГ/Л) В СУХИХ ВИНАХ
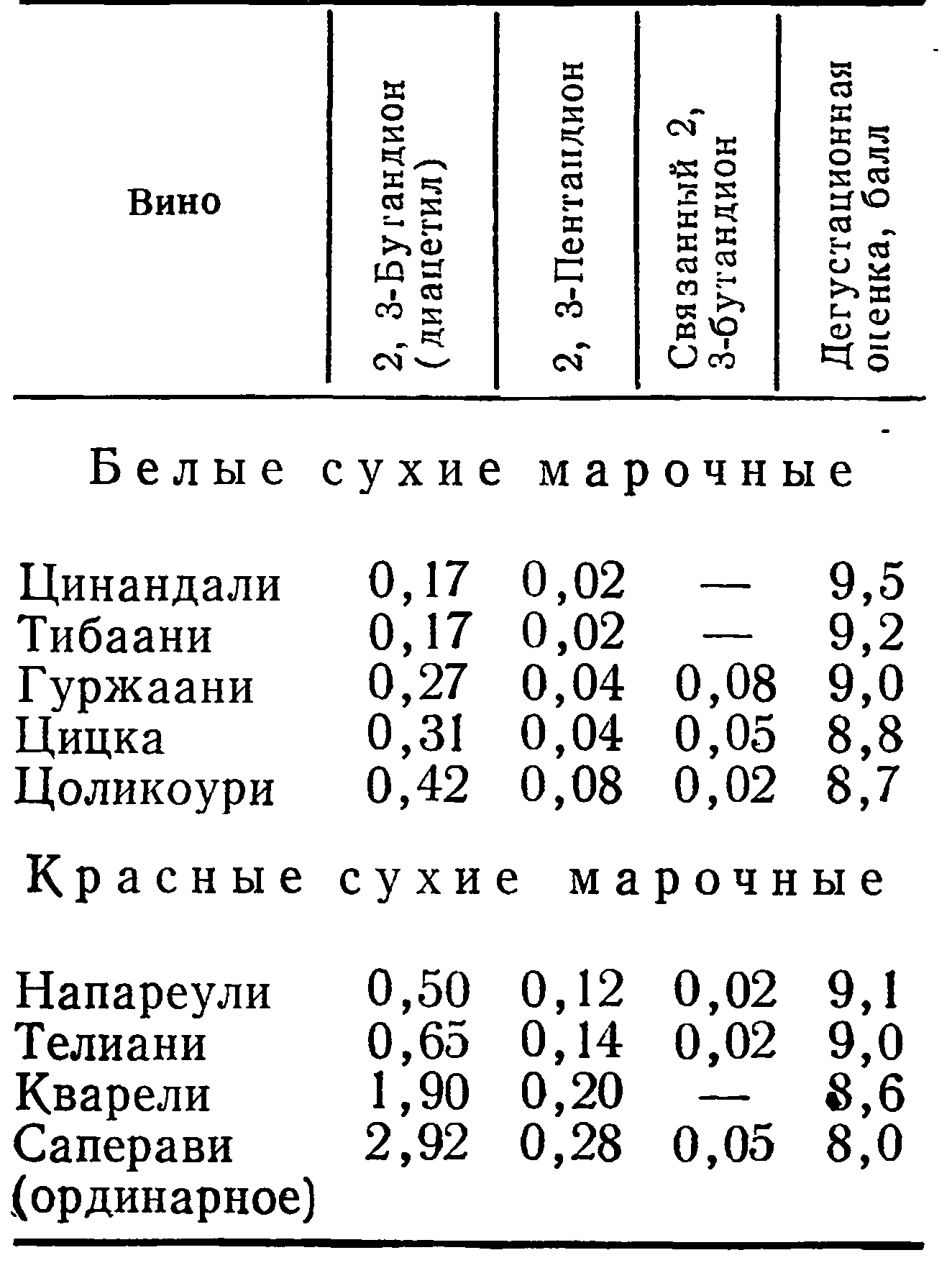
Таблица 15 СОДЕРЖАНИЕ ОКСИКЕТОНОВ (В МГ/Л) В СУХИХ ВИНАХ /

Нами совместно с А. В. Кавадзе и И. А. Егоровым [43] было показано, что определение дикетонов на газовом хроматографа «Газхром 11-09» с детектором по захвату электронов дает более точные результаты, чем спектрофотометрирование.
При отгоне дикетонов, в частности диацетила, происходит распад α-ацетооксикислоты и увеличивается содержание диацетила и пентандиона. Определение 2,3-бутандиола и 2,3-пентандиола в винах основывалось на их окислении бромом сначала до оксидикетонов (по методу Лемуана, 1928 г.), а затем (по методике окисления) до дикетонов [179]. Пользуясь этим методом, А. В. Кавадзе определял содержание дикетонов и оксикетонов в „грузинских винах. Результаты анализа приведены в табл. 14 и табл. 15.
Из данных табл. 14 и 15 видно, что в наибольшем количестве в винах содержится 2,3-бутандиол, затем З-окси-2-бутандион (ацетоин) и 2,3-пентадиол, наименьшее количество — 2,3-бутандиона (диацетила) и 2,3-пентандиона. В процессе алкогольного брожения ацетоин в результате протекания восстановительных процессов восстанавливается в 2-3-бутандиол, поэтому он и накапливается в больших количествах (до 680 мг/л).
Содержание ацетоина в винах колеблется от 8,03 до 36,18 мг/л, а диацетила — от 0,17 до 2,92 мг/л.
2,3-Бутандион, З-окси-2-бутандион и 2,3-бутандиол — соединения с 4 углеродными атомами в цепи, они, как показано, составляют окислительно-восстановительную систему в винах. Аналогичные три соединения, но с 5 углеродными атомами, были найдены нами в винах [43]. Содержание 2,3-пентадиола колеблется от 0,6 до 18 мг/л, 3-окси-2-пентанона от 0,45 до 2,80 и 2,3-пентандиона от 0,02 до 0,28 мг/л.
Винные дрожжи в процессе алкогольного брожения способны восстанавливать 2,3-пентандион и образовывать значительное количество 2,3-пентандиола.
Полученные данные свидетельствуют о том, что в винах существует окислительно-восстановительная система соединений с 5 углеродными атомами, аналогичная окислительно-восстановительной системе из соединений с 4 углеродными атомами в цепи.

Данные табл. 14 показывают, что чем меньшее количество 2,3- бутандиона (диацетила) и 2,3-пентандиона в винах, тем выше их дегустационная оценка.
Красные марочные вина обычно содержат больше 2,3-бутандиона и 2,3-пентандиона, чем белые, и дегустационная оценка их заметно ниже. Видимо, красящие вещества связывают эти карбонильные соединения. Так, вина Напареули и Телиани содержали соответственно 0,50 и 0,65 мг/л 2,3-бутандиона и оценены 9,0 и 9,1 балла, а вино Кварели с 1,9 мг/л получило при дегустации только 8,6 балла.
Известно, что в винах, подвергшихся яблочно-молочному брожению, количество 2,3-бутандиона значительно увеличивается и достигает 2,8—4,3 мг/л. При проветривании вин количество его также увеличивается. Этому способствует содержание в винах ионов железа и меди, которые катализируют окисление З-окси-2- бутанона в 2,3-бутадион.
Большие количества диацетила в белых (выше 0,8—0,9 мг/л) и красных винах (больше 1,8 мг/л) придают вину окисленный тон, при концентрации выше 2 мг/л окисленный тон переходит в мышиный привкус.
Наши исследования, проведенные еще в 1952—1957 гг., показали, что сухие вина после окончания брожения не рекомендуется подвергать аэрации. Окисленные шампанские виноматериалы следует обескислороживать биологическим методом, а потом шампанизировать. При этом активные дрожжи быстро восстанавливают диацетил в ацетоны, а качество получаемого шампанского улучшается.
Н. Г. Саришвили, А. Е. Орешкина и С. А. Брусиловский [85] разработали способ ускоренного биологического обескислороживания шампанских виноматериалов при тепловой обработке и шампанизации в непрерывном потоке.
В последнее время в США, Англии и других странах диацетил из пива удаляют активными дрожжами или ферментными препаратами типа редуктаз, полученными из дрожжей или из бактерий [179]. Процесс проводят быстро, нагревая пиво в течение 4 мин при 80°С или 15 мин при 60°С с одновременным введением активных дрожжей и кизельгура [104].
Таким образом, содержание диацетила может подвергаться регулированию путем проведения того или иного технологического приема, что позволяет улучшать качество выпускаемого продукта.

