Н.М. Зеленянська, к.с.-г.н., зав відділом розсадництва і розмноження винограду Національний науковий центр «Інститут виноградарства і виноробства ім. В.Є. Таїрова», О.П. Дикань, д.с.-г.н., професор, завідувач кафедри виноградарства ПФ НУБ і П України «КАТУ»,
О.В. Бабак, аспірант кафедри виноградарства ПФ НУБ і П України «КАТУ»
ІНДУКЦІЯ ФЛУОРЕСЦЕНЦІЇ ХЛОРОФІЛУ ЛИСТКІВ ВИНОГРАДУ У ЗВ’ЯЗКУЗІ СПОСОБОМ ВЕДЕННЯ ВЕГЕТУЮЧИХ ПАГОНІВ
Приведені результати дослідження індукції флуоресценції хлорофілу листків винограду сортів Ркацителі та Каберне-Совиньйон в залежності від способу ведення пагонів. Встановлено, що найбільш оптимальним, з точки зору функціонування фотосинтетичного апарату, є спосіб ведення вегетуючих пагонів кущів винограду вертикально вниз.
Вступ.
Процес фотосинтезу є основним джерелом енергії, що забезпечує ріст і розвиток рослин відповідно до генетичної програми. Тому функціонування фотосинтетичного апарату є найбільш вагомою ознакою визначення функціонального стану рослин у цілому [1]. В виноградарстві процесу фотосинтезу надають великого значення при формуванні кущів винограду. Встановлено, що тільки при оптимальному розміщенні пагонів забезпечується повне використання листками сонячної радіації, і навпаки, із збільшенням густоти розміщення пагонів на шпалері, чиста продуктивність фотосинтезу з одиниці листкової поверхні зменшується [2, 3]. Для підвищення інтенсивності фотосинтезу багато науковців рекомендують надавати перевагу формам кущів з вільним розміщенням приросту [4, 5]. Встановлено, що саме такі типи кущів забезпечують надходження на кожний 1 см2 листкової поверхні сонячної енергії в кількості 0,850 кал/см2-хв., забезпечують достатню силу росту кущам, добру освітленість та провітрюваність крони [6], що так необхідно для процесу фотосинтезу [7]. З таким твердженням повністю погоджуються багато науковців та виноградарів-практиків, які у своїх дослідженнях та практичних розробках показали залежність сили росту та розвитку кущів, інтенсивності перебігу фізіологічних процесів і продуктивності від обраної схеми посадки та типу формування кущів винограду [2, 4-6].
Дослідженнями по визначенню інтенсивності фотосинтезу в залежності від різних факторів зовнішнього середовища займалися багато вчених. І як результат було показано тісний взаємозв’язок індукційних процесів флуоресценції хлорофілу листків з функціонуванням фотосинтетичного апарату [8-11].
Складну кінетичну криву індукційних переходів флуоресценції хлорофілу (ФХ) зелених клітин можна розділити на ряд добре виражених ділянок, для яких прийняті стандартні позначення (рис. 1).
Одразу після вмикання діючого світла спостерігається швидкий ріст флуоресценції (О-І), який відображає фотохімічне відновлення р. Через декілька десятків мілісекунд після початку освітлення ріст флуоресценції сповільнюється (143), що пов’язано з початком відтоку електронів від Q до фотосистеми (ФС) І. Але оскільки на початку освітлення у адаптованого до темноти об’єкту не відбувається відтікання відновлених еквівалентів із ланцюга внаслідок неактивності ФД: НАДФ+ - редуктази, пул електронних ємностей на акцепторній стороні ФС І швидко заповнюється. В результаті цього всі первинні акцептори ФС II відновлюються і ФХ зростає до максимального рівня Р. Після досягнення максимального рівня вихід ФХ спадає до стаціонарного рівня. Світловий спад ФХ, як і її зростання немонотонний, що свідчить про його складну природу [1].
Тому сьогодні для оцінки функціонування фотосинтетичного апарату рослин широко застосовують люмінесцентні методи. Вони характеризуються високою точністю, дозволяють проводити виміри на рослинних об’єктах, не порушуючи їх цілісності, отримувати експрес-інформацію про стан клітин організму [12-14]. Достовірність використання методів індукції флуоресценції хлорофілу (ІФХ) для визначення інтенсивності роботи фотосинтетичного апарату рослин доведено класичними методами [15, 16]. В ряді досліджень було показано, що параметри ІФХ успішно застосовували в рослинництві з діагностичною метою [9, 15, 17].
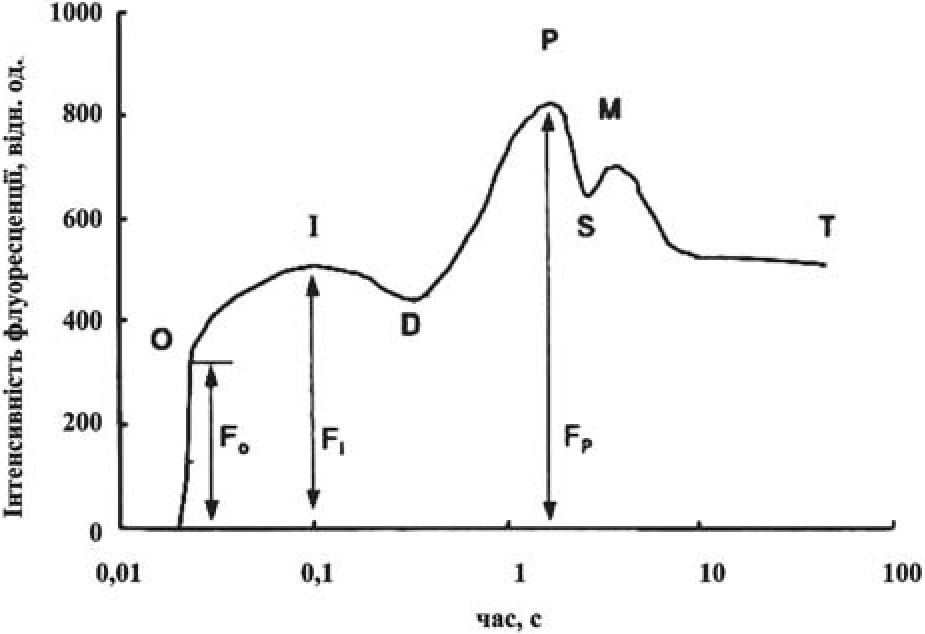
Рис. 1. Кінетика змінної флуоресценції листків зелених рослин.


Рис. 2. Вимірювання ІФХ листків винограду з використанням хронофлуорометра «Флоратест».
Але в літературі відсутні відомості про проведення подібних досліджень у виноградарстві, і особливо для визначення оптимальних формувань кущів. Тому метою нашої роботи було проведення аналізу кривих індукції флуоресценції хлорофілу листків та встановлення можливості застосування методу ІФХ для визначення оптимального способу ведення вегетуючих пагонів кущів винограду.
Методика та методи досліджень.
Роботу проводили на базі Національного наукового центру «Інститут виноградарства і виноробства ім. В.Є. Таїрова» в відділі розсадництва і розмноження винограду. Дослідження виконували протягом 2008-2009 років на технічних сортах винограду Каберне-Совіньйон та Ркацителі. Схема посадки кущів 3x2,5 м, форма - двоштамбовий кордон, з висотою штамба 80 см.
Схема досліджень включала наступні варіанти вимірювання ІФХ на вегетуючих пагонах різного положення на шпалері:
- варіант - вільне розміщення пагонів, вертикально вниз (що відповідало одному ярусу подвійних дротів);
- варіант - напіввільне розміщення пагонів (що відповідало двом ярусам подвійних дротів);
- варіант (контроль) - розміщення пагонів вертикально вгору (що відповідало трьом ярусам подвійних дротів).
Листки для вимірювань відбирали вранці з 8 до 9 години 21 липня 2008 р. і 23 липня 2009 р. в районі 10 міжвузля добре розвинені, без видимих уражень шкідниками та хворобами, однакові за розмірами. Вимірювання індукції флуоресценції хлорофілу листків проводили за допомогою портативного хронофлуорометра „Флоратест”, розробленого співробітниками інституту кібернетики ім. В.М. Глушкова НАН України (м. Київ) (рис. 2).

Рис. 3. Зміна індукції флуоресценції хлорофілу листків сорту винограду Ркацителі при різних способах ведення вегетуючих пагонів.
Після 3-хвилинної темнової адаптації листкової пластинки проводили вимірювання флуоресценції хлорофілу шляхом освітлення листків синім світлом. Цикл вимірювань тривав 3 хвилини, після чого отримані значення за допомогою спеціально розробленої в ІК НАНУ програми „Флоратест 1” передавали в ПК для подальшої математичної обробки в програмі Місrоsоft Ехсеl. Кількість вимірювань ІФХ для кожного способу ведення пагонів сортів складала 5 разів у 3 повторностях.
Результати досліджень.
Результати вимірювання параметрів індукції флуоресценції хлорофілу листків винограду сортів Ркацителі (рис. 3) та Каберне-Совіньйон (рис. 4) показали, що положення пагонів в просторі суттєво впливало на ІФХ і проявлялося у зміні певних ділянок кривої Каутського, але загальний вигляд кривих ІФХ залишався однаковим, що повністю узгоджується з літературними даними [18, 19].
Розглянемо зміну індукції флуоресценції хлорофілу листків винограду сорту Ркацителі в залежності від способу ведення вегетуючого приросту. Згідно з даними рис. 2 найменшою амплітудою, а відповідно і найменшою інтенсивністю флуоресценції, характеризувалася крива ІФХ у варіанті з вільним розміщення пагонів вертикально вниз. Максимум кривої ІФХ знаходився у межах 0,6689-0,6738 відносних одиниць. У варіанті з напіввільним розміщенням пагонів амплітуда збільшувалась порівняно з варіантом 1, але не перевищувала контрольний варіант. Крива ІФХ характеризувалася максимумом, який дорівнював 0,7373-0,7446 відносних одиниць. Найбільшим показником ІФХ характеризувалися листки винограду у контролі (розміщення пагонів вертикально вгору) і максимум ІФХ складав 0,8081-0,8179 відносних одиниць.
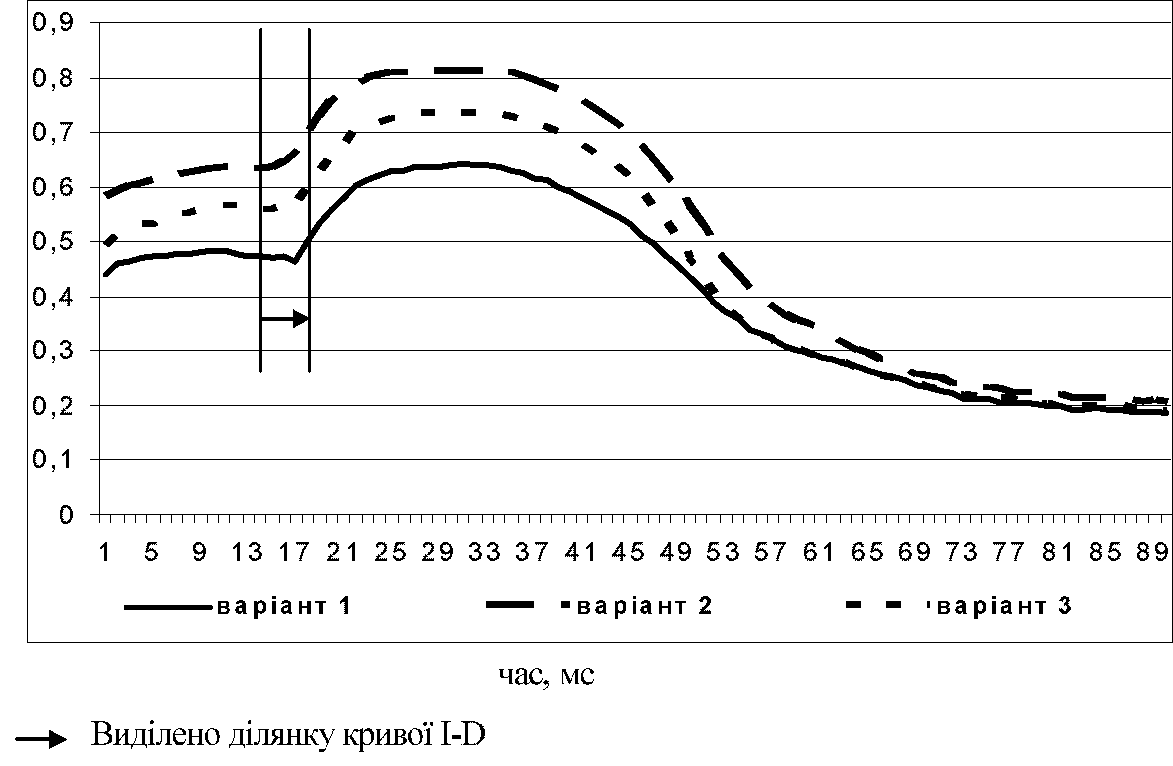
Рис. 4. Зміна індукції флуоресценції хлорофілу листків сорту винограду Каберне-Совіньйон при різних способах ведення вегетуючих пагонів.
Проаналізувавши дані літератури ми припускаємо, що інтенсивність фотосинтезу була найбільшою в варіанті 3 з розміщенням пагонів вертикально вниз, дещо нижчою інтенсивністю фотосинтезу характеризувалися листки рослин з напіввільним розміщення пагонів, і найнижчою - характеризувалися рослини з веденням приросту вертикально вгору. Адже при активному фотосинтезі, коли всі реакційні центри знаходяться в відкритому робочому стані, майже вся поглинута енергія світла використовується в процесі фотосинтезу. І тільки невелика її частина (не більше 3%) переходить в енергію світла, так званої фонової флуоресценції (Fо). Як правило, в нормальних умовах величина Fо невелика, що свідчить про активне використання клітинами енергії поглинутого світла. Але якщо при будь- яких впливах (у нашому випадку це різна інтенсивність освітлення при різних способах ведення приросту кущів) порушується стан фотосинтетичних мембран, то реакційні центри переходять у неактивний (закритий) стан, призупиняється потік електронів в первинних процесах фотосинтезу. За таких умов поглинута енергія світла уже не може використовуватися, і флуоресценція хлорофілу зростає. Саме таке явище характерно для контрольного варіанту. Це наочно підтверджується і в наших дослідженнях значенням фонової флуоресценції, показник якої достовірно змінювався залежно від варіанту досліду. Так, рівень Fо у сорту Ркацителі складав 0,4174 відносних одиниць (варіант 1), варіант 2 - 0,4883 та 0,5323 відносних одиниць 3 варіант (контроль).
Практично аналогічну залежність амплітуди кривих ІФХ та показника Fо було відмічено і у технічного сорту Каберне-Совіньйон (рис. 4).
Криві індукційних переходів ІФХ у листків за різної інтенсивності освітлення суттєво відрізняються, ілюструючи відмінності в активності їх фотосинтетичного апарату [1, 10, 11]. Після вмикання світла ІФХ збільшується значно швидше у листків, які знаходилися в більш затіненому стані, причому у кінетиці росту ІФХ у них значно менше виражена ділянка кривої І-D (на графіку позначена). Це вказує на більш ефективний відтік електронів від ФС II до ФС І порівняно з фотовідновленням первинного акцептора ФС II. Ці дані повністю узгоджуються із результатами наших досліджень, які показують, що найкраще ділянка І-D кривої ІФХ виражена у варіантах 1 обох сортів. Вона малопомітна на кривих ІФХ з найбільшою амплітудою (для сорту Ркацителі це в варіанті 3, для сорту Каберне-Совіньйон - варіант 2).
Більшій швидкості та продуктивності фотосинтезу, як правило, відповідає більш інтенсивне світлове гасіння змінної флуоресценції до рівня 8МТ, тобто більш низького стаціонарного рівня. Проаналізувавши дані наших досліджень за цим показником ми прийшли до висновку, що у обох сортів досягнення стаціонарного рівня кривою ІФХ під час світлового спаду відбувалося значно швидше також у варіантах з вільним розміщенням пагонів вертикально вниз. Так, наприклад, у сорту Каберне-Совіньйон це явище спостерігали на 73 мс в варіанті 1 і на 81 мс в варіантах 2 та 3, у сорту Ркацителі відповідно на 77 мс та 88 мс.
Висновки.
Проаналізувавши дані наукових джерел та результати наших досліджень ми прийшли до висновків:
- Метод індукції флуоресценції хлорофілу листків є досить чутливим, інформативним методом, який можна використовувати для виявлення інтенсивності функціонування фотосинтетичного апарату рослин. Зростання ІФХ листків свідчить про порушення стану фотосинтетичних мембран та гальмування потоку електронів в первинних процесах фотосинтезу.
- Згідно з результатами наших досліджень, найбільш оптимальним, з точки зору функціонування фотосинтетичного апарату, є спосіб ведення однорічного приросту кущів винограду з вільним розміщенням пагонів вертикально вниз. ІФХ за вище названого способу ведення пагонів була найменшою. Це свідчить про найефективніше використання світлової енергії для синтезу органічних речовин.
СПИСОК ЛІТЕРАТУРИ
- Карапетян Н.В., Бухов Н.Г. Переменная флуоресценция хлорофилла как показатель физиологического состояния растений // Физиология растений. — 1986. — Т. 33. — №5. - С.1013-1026.
- Павлюкова Н. Ф. Продуктивность сортов винограда в зависимости от формировки // Садоводство и виноградарство. — 2001. - № 5. - С. 23-24.
- Малтабар Л.М., Василевский И.Н. Продуктивность и эффективность возделывания сорта Каберне-Совиньон при разных технологиях // Виноделие и виноградарство. — 2006.
- № 3. - С. 50-52.
- Гаврилов Г.П. Эффективность штамбовой формы куста со свободно свисающими побегами // Садоводство, виноградарство и виноделие Молдовы. — 1991. — № 3. — С. 24-25.
- Дикань А.П., Костюченко В.Е. Выбор формы кустов винограда для условий предгорья Крыма // Научные труды «КГАТУ». Сельскохозяйственные науки. Вып. 86. — Симферополь, 2004. — С. 170-184.
- Дубинко В.К., Матвиенко М.Н. Продуктивность винограда в зависимости от способа размещения плодовых лоз на шпалере // «Виноградарство» Сборник научных трудов. - Одесса, 1973. - С. 44-49.
- Павлюкова Н. Ф. Продуктивность сортов винограда в зависимости от формировки // Садоводство и виноградарство. — 2001. - № 5. - С. 23-24.
- Чулков В.В. О размещении побегов винограда на шпалере // Садоводство и виноградарство. - 1999. - №3. - С.19-20.
- Зеленянська Н.М., Сарахан Е.В., Буркан Н.В., Тулінова Н.В. Флуоресценція хлорофілу та водний режим листків саджанців винограду / / Вісник аграрної науки. — 2008. — № 9. - С. 25-27.
- Гаевский Н.А., Моргун В.Н. Использование переменной и замедленной флуоресценции хлорофилла для изучения фотосинтеза растений // Физиология растений. — 1993. - Т. 40. - № 1. - С.136-144.
- Веселовский В.А., Веселова Т.В. Люминисценция растений. Теоретические и практические аспекты. — М.: Наука, 1990. - 200 с.
- Шерер В. А. Замедленная флуоресценция листьев винограда в связи с морозоустойчивостью // Физиология и биохимия культурных растений. — 1987.- Т. 19, № 2. — С. 170-174.
- Hsu В. A theoretical study on the fluorescence induction curve of spinach thylakoids in the absence of DCMU / / Ibid. - 1992. - 1040. - N 1. - P. 30-36.
- Cao I., Govindjee. Chlorophyll fluorescence transient as a indicator of active and inactive photosystem II in thylakoid membranes // Ibid. - 1990. - 1015, N 2. - P. 180-188.
- Корнеев Д.Ю., Григорюк И. А., Михальский Н.Ф., Давыдков С.А. Влияние полистимулина К на индукцию флуоресценции хлорофилла и водный дефицит листьев озимой пшеницы в условиях кратковременной засухи // Физиология и биохимия культурных растений. — 2001. — Т. 33. — № 2. - С. 165-169.
- Рубин А.Б. Первичные процессы фотосинтеза // Соровский образовательный журнал. - 1997. - №10. - С.79-84.
- Зеленянская Н.Н. Експресс-диагностика состояния саженцев винограда в стрессовых условиях // Современные достижения в виноградарстве и виноделии: Тез. докл. междунар. конф., Кишинев 18-19 сентября 2008. — С.137-139.
- Веселова Т.В., Веселовский В.А., Гриненко В.В. и др. Влияние обезвоживания на длительное послесвечение листьев винограда // Физиология растений. — 1973. — Т. 20. - Вып. 1. - С. 47-53.
- Голодрыга П.Я., Китлаев Б.Н. Сверхслабое излучение растений и его прикладное значение // Виноградарство и виноделие СССР. — 1968. - № 8. - С. 52-55.

