Глава IV
СТАБИЛИЗАЦИЯ СОКОВ И ВИН ИММОБИЛИЗОВАННЫМИ КИСЛЫМИ ПРОТЕИНАЗАМИ
Технология обработки вин иммобилизованными ферментами
Благодаря достижениям инженерной энзимологии, технической биохимии и микробиологии, в последнее десятилетие стало возможным расширить область применения гетерогенного катализа на основе фиксированных клеток микроорганизмов, иммобилизованных химических катализаторов в различных отраслях пищевой промышленности, в том числе и в виноделии.
В технологии получения препаратов микроорганизмов и ферментов для гетерогенного катализа принято различать следующие операции:
фиксированные клетки микроорганизмов или молекул ферментов (адсорбцией и сорбцией на поверхности носителя);
включенные клетки микроорганизмов и молекул ферментов в структуре материала носителя (в геле полиакриламида, пористых силикатных гелях и т. д.);
иммобилизация ферментов связыванием молекул фермента с активными реакционноспособными группами на поверхности носителя посредством образования химических связей (например, ковалентной).
Основные преимущества, на наш взгляд, гетерогенного ферментативного катализа перед гомогенным в современной технологии виноделия следующие:
- фиксация клеток микроорганизмов или молекул ферментов на поверхности носителей и создание тем самым условий высокой концентрации их, сведения до минимума сложности диффузии субстратов из сока, вина на поверхности катализатора и на этой основе существенная интенсификация многих технологических процессов;
- создание поточных автоматизированных схем обработки сусла, сока и вина применением реакторов с фиксированными клетками микроорганизмов или молекул ферментов;
- исключение (при иммобилизации) или ограничение (при фиксации) попадания микроорганизмов и ферментов в обрабатываемый продукт.
В таблице 47 приведены примеры успешного применения в виноделии гетерогенного ферментативного катализа, часть из них широко внедряется в производство, а некоторые находятся на стадии испытания в условиях производства или дальнейшего совершенствования.
В настоящей работе авторы приводят результаты исследований по стабилизации виноградных вин иммобилизованными кислыми протеиназами в комплексе с другими приемами, обеспечивающие получение стабильных продуктов при хранении в течение года и больше.
Для гидролиза виноградного протеина в колоночном режиме была использована лабораторная установка, аналогичная описанной в работе В. Б. Янушкаускайте, Л. В. Козлова, В. К. Антонова (1975).
Расчет таких кинетических констант, как степень расщеплений субстрата, реакционная емкость колонок, концентрация фермента, характеризующих работу реакторов, осуществляли с использованием известных методов инженерной энзимологии (Березин, 1976).
Пролонгированность действия — один из наиболее важных технологических показателей при оценке способов получения и приемов использования иммобилизованных ферментов. Эффективность использования иммобилизованных ферментов существенным образом зависит от продолжительности действия препаратов, их удельной активности и стоимости единиц активности (Семпер, Кестнер, 1974). Анализ литературных данных показывает, что протеиназы (в том числе кислые) отличаются от ряда других ферментов меньшей продолжительностью сохранения активности. Полупериоды работы глюкоамилазы и папаина при температуре 45°С равны соответственно 645 и 35 дням (Витол, 1973), а продолжительность работы колонок с глюкоамилазой и пепсином, иммобилизованными на пористом стекле, составили соответственно 1000 и 30 дней (Витол, 1975).
Таблица 47
Процессы виноделия, осуществляемые на основе применения гетерогенного катализа



Полупериод сохранения активности как важный показатель, характеризующий работу препарата или реактора в целом, мы оценивали экспоненциальной кривой падения активности с помощью уравнения (Витол, 1973):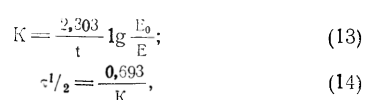
где К — константа распада ферментов, час-1;
t — рабочее время колонки, час;
Ео — начальная активность фермента, ед./г;
Е —активность момента времени, ед./г;
1/2— полупериод сохранения активности, час. Определение оптимальных условий ведения процесса гидролиза белков вин и соков в колоночном реакторе проводили построением зависимости степени гидролиза белка (Р, %) и значения избыточного давления на входе
в реактор (ΔΡ) от значения критерия Рейнольдса (Re), определенного по формуле:
![]() (15)
(15)
где V — линейная скорость потока, м/сек;
L — длина реактора, м;
v — кинематическая вязкость столового вина при температуре определения, 10-4 м2/сек.
Кинематическую вязкость вина определяли по формуле Субботина.
Время контакта продукта в реакторе определяют по известным в колоночной хроматографии принципам (Детерман, 1970).
Благодаря высокой концентрации и активности протеиназ на носителях и их стабильности в растворе, время контакта в колоночном реакторе с иммобилизованным протаваморином при обработке осветленного сусла (средние за цикл) составило 16—18 сек по сравнению с 12—16 час (Наниташвили, 1972) для этого же фермента при ферментативной обработке виноградного сусла растворимым ферментом. Время контакта обрабатываемого продукта в реакторе с иммобилизованным ферментом также может быть использовано при проектировании промышленных реакторов.
Нами в сезонах виноделия 1973—1976 гг. в винкомбинате «Золотая балка» испытывалась система из трех колоночных реакторов с иммобилизованным протаваморином при обработке столового вина из сортов Рислинг, Алиготе. При полупериоде сохранения активности протаваморина, равном 216 часов, система работала непрерывно 21 день, после чего головной реактор был отключен для регенерации препарата фермента, иммобилизованного на порошкообразном титане.
Очевидно, что многореакторные системы с иммобилизованными кислыми протеиназами, входящие в состав автоматизированных установок по обработке соков и вин с целью их стабилизации, составят основу будущего широкого применения гетерогенного катализа в виноделии, соковом производстве, пивоварении и других отраслях.
Применение иммобилизованных протеиназ и других ферментов в винодельческом производстве открывает широкие возможности для создания автоматизированных поточных технологических схем обработки вин (Датунашвили, Павленко, Ганна и сотр., 1975).
При разработке аппаратурного оформления процесса гидролиза белков сусла и вина с целью их стабилизации против белковых помутнений мы ориентировались на максимальные улучшения следующих показателей: высокая степень автоматизации технологического процесса;
снижение затрат труда на лабораторно-аналитические работы;
повышение производительности труда обслуживающего персонала и ряд других показателей.
Основным критерием эффективности обработки вин иммобилизованными кислыми протеиназами является стабильность напитков против белковых помутнений. Для ее оценки исследовали поведение вин при длительном их хранении (год и более, ГОСТ 5575—69), а также при выдержке вин в провокационных условиях: повышенная и пониженная температура; действие дневного света.
Степень протеолиза оценивается сразу после обработки вин по остаточному содержанию белковых веществ и с помощью теста на склонность вин к белковым помутнениям.
Однако этот прием дает информацию, значительно смещенную но времени, что не позволяет эффективно (синхронно) контролировать и регулировать процесс обработки вин.
Остаточное содержание белка в вине, не вызывающее белковых помутнений, должно составить не более 20 мг/л (Троост, 1959). Однако это весьма условное определение максимального остаточного содержания белка, не вызывающего белковых помутнений. Очевидно, образование белковых помутнений обусловлено не только количественным его содержанием в вине, но и его свойствами: изоэлектрическая точка и заряд различных фракций протеина (Барна, 1974; Датунашвили, 1975); степень комплекса образования с окисленными фенольными веществами и полисахаридами (Датунашвили, Павленко, Маликова, 1971), а также с ионами солей железа (Яцына, 1966). При этом важную роль играют химический и биохимический состав сусла и вин, активность собственных ферментативных систем, технология получения различных типов вин (Датунашвили, 1975; Кишковский, Сахарова, Коссобудская, 1975).
Нами в производственных условиях на предприятиях винодельческого производства Крыма проводились исследования влияния остаточного содержания белка в винах на их стабильность к белковым помутнениям при длительном хранении. Для этого осветленное виноградное сусло и вина различных типов обрабатывались по схемам, принятым на предприятиях МПП СССР, в комплексе с иммобилизованным протаваморином Г25х из расчета получения остаточного содержания белка от 2,0 до 20,0 мг/л. Вина характеризовались содержанием общего железа в количестве 3,3—4,1 мг/л, сернистой кислоты (общей) в столовых винах—100—125 мг/л, в крепленых — 85—100 мг/л.
Таблица 48
Влияние остаточного содержания белковых веществ на стабильность вин при хранении

Сумма фенольных веществ снизилась после обработки вин поливинилпирролидоном (ПВП) на 26—33% от исходного содержания. В обработанных образцах определяли склонность к белковым помутнениям с помощью одного из наиболее чувствительных тестов — нагрев с 1%-ным раствором танина (Датунашвили, Павленко, Маликова, 1971; Чакыру, Лепэдату, 1973) и далее образцы разливались в бутылки и закладывались на длительное (до 14 мес.) хранение в винподвале при температуре 14—16°С. Ежемесячно проводили обследование прозрачности вин. Идентификацию образовавшихся помутнений проводили по методике С. Т. Огородник (1972). При появлении в винах помутнений (осадков) небелкового характера, полисахаридного, полифенольного их исключали из опыта.
В таблице 48 представлена часть результатов многолетних наблюдений, из которых следует, что стабильны к белковым помутнениям в течение года и более образцы вин с различным содержанием белка: столовые вина—9 мг/л, портвейн белый—10, десертное белое — 7 мг/л. Стабильность в течение 6 месяцев и более наблюдали в образцах с содержанием белка в пределах 17—19 мг/л и ниже. Следует отметить, что отрицательный тест с танином на белковые помутнения коррелировал со стабильностью в течение 8 и более месяцев.
Статистическая обработка наших наблюдений на винодельческих предприятиях Молдавии, Крыма и Кубани, а также данных из источников литературы (Яцына, 1965; Датунашвили, Павленко, 1970; Наниташвили, 1973; Буланча, 1974) о зависимости между остаточным содержанием белков в винах и их стабильностью к помутнению позволила выявить коррелятивную зависимость между степенью гидролиза белковых веществ, при которых образцы не мутнели, и их стабильностью при хранении в течение года и более. Оптимальная степень гидролиза белковых веществ для вин с исходным содержанием белка от 10 до 76 мг/л составляет 75— 90%, при их содержании от 75 и выше — 90—96%. Полученные показатели степени гидролиза белковых веществ вина были использованы в работе при оценке эффективности протеолиза.

Рис. 25. Принципиальная схема установки автоматического контроля регулирования процесса обработки соков и вин иммобилизованными протеиназами:
1 — насос-дозатор с регулируемой производительностью; 2 — колоночный реактор; 3 — насос-дозатор перистальтический; 4 —емкость; 5 — колонка для гель-фильтрации; 6 — смеситель; 7 — теплообменник; 8 — денситометр; 9 — нефелометр; 10 — автоматический потенциометр.
Условные обозначения; коммуникации с обрабатываемым продуктом — ; контур механизма обратной связи.
Очевидно, 20 мг/л белка и является тем предельным содержанием его в вине, которое обеспечивает стабильность 6 и более месяцев (Троост, 1959) при условии высококачественного выполнения комплексной обработки. Необходимо отметить, что тест с танином на склонность к белковым помутнениям можно применить для оценки стабильности в винах с содержанием общего железа до 10 мг/л (т. е. после деметаллизации); в наших исследованиях деметаллизацию соков проводили с использованием фосфорного эфира целлюлозы (ФЭЦ).
При использовании иммобилизованных ферментов нами была усовершенствована оценка протеолиза путем перевода ее на автоматический и непрерывный режим и разработан узел контроля гидролиза белка, входящий в состав лабораторной и полупроизводственной установок для обработки соков и виноматериалов с целью их стабилизации против белковых помутнений (рис. 25).
Количественное определение белковых веществ в сусле, соке и вине проводили с помощью гель-фильтрации пробы на аналитических колонках по модифицированному нами методу Н. Самерса и К. Зимениса (1972). Узел полуавтоматического определения белка работает следующим образом. На выходе из реактора (2) с помощью насоса-дозатора (3) отбирается 5 мл обработанного продукта (сусла или вина) и вносится в колонку (5), заполненную сефадексом G-25 или каким-либо другим препаратом, обладающим молекулярно-ситовым эффектом (Молселект G-50, Сферон и др.). Далее из резервуара (4) подается ацетатный буфер (0,1 м) со скоростью 150 мл/ч и одновременно производится запись кривой элюции при а=230 нм на денситометре (8) с регистрирующим прибором (10). По окончании записи кривой фиксируется значение высоты (мм) первого пика на денситограмме. Методом микрокьельдаля определяли содержание общего азота в первой фракции к пересчитывали на белок (метод определения содержания белка во фракции по Лоури дал менее удовлетворительную воспроизводимость результатов, однако сто также можно использовать для указанных целей). Предварительно определяли высоту пика псовой фракции высокомолекулярных веществ и содержания белка в исходном продукте. По полученным данным определяли исходную степень гидролиза белка, а также соответствующее ей снижение высоты пика. Далее с помощью механизма обратной связи регулировали скорость потока, обеспечивающую необходимую (оптимальную) степень гидролиза. По ходу процесса измеряли лишь высоту первого пика. Метод весьма эффективен при обработке в реакторах больших однородных партий сокоматериалов или вин; он довольно быстро определяет истинное содержание белка в пробе.
Контроль на склонность к белковым помутнениям обработанных соков и вин иммобилизованной кислой протеиназой осуществляли следующим образом. Обработанный продукт на выходе из реактора (2) и 1%-ный раствор танина с интервалом через 3—4 часа подавали насосом-дозатором (3) в смеситель (6) в соотношении 10:1, далее в змеевиковый реактор (7) с температурой 100°С, где смесь выдерживали 5 мин с последующим охлаждением до 20—25оС во второй секции реактора. На выходе из реактора (7) смесь нефелометрируется в нефелометре (9) при одновременной записи точек (кривой) мутности прибором (10).
Если значение мутности пробы в тесте с танином для обработанного образца находится на уровне, не превышающем 0,30 формазиновых единиц, то можно считать, что полученный прοдукт не склонен к помутнениям. С началом падения активности ферментов в реакторе наблюдается снижение степени гидролиза белка и увеличение мутности при реакции с танином. В этом случае при импульсном отклонении электронного потенциометра происходит уменьшение скорости потока. Последнее приводит к увеличению времени контакта субстрата с ферментом в реакторе и, следовательно, повышению степени гидролиза протеина.
Испытания описанной схемы в лабораторных и производственных условиях и на винзаводе Предгорного опытного хозяйства ВНИИВиВ «Магарач» при стабилизации молодого виноматериала обработкой иммобилизированным протаваморином показали, что на этой основе можно провести процесс в непрерывном потоке с автоматизацией его контроля и регулирования.
Таблица 49
Характеристика вин, обработанных иммобилизованным протаваморином в комплексе с другими приемами

Для выбора режимов обработки виноградных вин иммобилизованными кислыми протеиназами, на основе которых и строятся технологические схемы, в 1973, 1974 и 1975 годах велись исследования влияния данной обработки на химический состав и органолептическую оценку соков и вин.
Основными критериями перспективности стабилизации вин различных типов методом обработки иммобилизованной протеиназой являются обеспечение стабильности и сохранение высоких органолептических достоинств напитков.
Для оценки влияния обработки виноматериалов на химический, биохимический состав и органолептическую оценку готовых вин нами были обработаны молодые виноматериалы в колоночных реакторах с иммобилизованными кислыми протеиназами. Полученные результаты свидетельствуют, что наиболее существенные изменения претерпевают сумма коллоидов, содержание белка, фенольных и пектиновых веществ, в меньшей мере— содержание железа и других компонентов (табл. 49). Окислительно-восстановительный потенциал находится на уровне (или ниже) контрольных образцов. Это свидетельствует о том, что обработка вин не обогащает их кислородом и исключает опасность переокисления, особенно столовых вин.

