Полипептиды
Эти соединения состоят из аминокислот, связанных между собой пептидными связями. Молекулярная масса полипептидов составляет не более 10 000 D. Они осаждаются сульфатом аммония, фосфоровольфрамовой кислотой, как белки, но отличаются от белков тем, что не задерживаются целлофановой мембраной при диализе. Ди- и трипептиды не осаждаются этими реактивами.
Многие полипептиды встречаются в растениях и дрожжах, имеют важное значение как промежуточные продукты в обмене веществ и как физиологически активные вещества. Примером может служить глутатион. Он состоит из остатков трех аминокислот: гликокола, цистеина и глютаминовой кислот. Глютатион в значительном количестве содержится в дрожжах, откуда он и был выделен Ф. Гопкинсом.
Важная роль глутатиона в обмене веществ заключается в том, что он является сильным восстановителем и очень легко окисляется. При этом окисляется сульфгидрильная группа (—SH).
Две молекулы глутатиона соединяются дисульфидной связью (—S—S—) и образуют молекулу окисленного глутатиона.
Работами О. Т. Хачидзе [91] установлено, что полипептиды виноградного сока состоят из аланина, аргинина, валина, гистидина, глицина, глютаминовой и аспарагиновой кислот, лизина, треонина и серина.
В ягодах винограда полипептиды образуются в результате распада белков и путем синтеза из аминокислот.
По данным Ч. Пу и А. Урнака (1970), количество аминокислот, входящих в полипептиды, составляет от 70 до 90% от общего азота. Глицин, лизин, аспарагиновая кислота являются главными компонентами полипептидов.
Белки
В растениях белков содержится меньше, чем углеводов. Однако они играют большую роль в биологических процессах. Белковые вещества составляют основную массу протоплазмы. Все ферменты являются белками.
По химическому составу белки отличаются от углеводов тем, что они в своей молекуле, кроме углеродного скелета, содержат азот и серу, а некоторые и фосфор.
Методом рентгенографии установлено, что белки между собой различаются не только аминокислотным составом, но и формой молекулы. По этому признаку белки могут быть разделены на фибриальные (нитевидные) и глобулярные (шаровидные). К глобулярным белкам принадлежи большинство белков, содержащихся в растениях и дрожжах.
При определенных условиях белковые растворы превращаются в гели. В гелях вода находится в гидратационном состоянии. Высушенный гель теряет воду. При помещении такого геля в воду белок впитывает большое количество воды. Этот процесс называется набуханием геля. Процесс, обратный набуханию, т. е. отдача воды, называется синерезисом. Процесс набухания белков играет большую роль в пищевой промышленности, особенно в хлебопечении и в кондитерском производстве.
При нагревании белковых растворов, а также при действии кислот и щелочей, ионов тяжелых металлов, органических растворителей и др., белки денатурируются. Денатурированные белки теряют ферментативную активность. В начале денатурация имеет обратимый характер, позднее становится необратимой. Обычно денатурация сопровождается понижением растворимости, свертыванием и выпадением белка в осадок. Этот процесс называется коагуляцией. При этом он не сопровождается разрывом ковалентных связей в молекуле белка.
Денатурация вызывает нарушение вторичной, третичной и четвертичной структур белка и изменяет его биологические и физикохимические свойства. Денатурированные белки теряют способность реагировать с другими веществами, а также растворяться в воде.
Явление денатурации белков имеет важное значение в пищевой промышленности, в частности в виноделии. При нагревании
вина белки свертываются и вино приобретает стойкость к белковым помутнениям.
Белки осаждаются ацетатом свинца, гидроксидом меди, сульфатом аммония, вольфраматом натрия, а также танином.
Белки характеризуются следующими реакциями окрашивания: ксантопротеиновой, биуретовой, миллоновой и реакцией Адамкевича. Эти реакции характеризуют белковую молекулу, содержащую определенные химические группировки. Так, например, биуретовая реакция характеризуется наличием группы![]() , ксантопротеиновая — бензольных колец, реакция Адамкевича характеризуется наличием индольных групп, миллоновая реакция зависит от наличия фенольных группировок.
, ксантопротеиновая — бензольных колец, реакция Адамкевича характеризуется наличием индольных групп, миллоновая реакция зависит от наличия фенольных группировок.
Белки, подобно аминокислотам, содержат как карбоксильные, так и аминные группы, поэтому они обладают амфотерными свойствами. Они могут диссоциировать и как кислоты, и как основания. В кислой среде они образуют катионы, а в щелочной — анионы. Исходя из этого, при электрофорезе молекула белка в щелочном растворе будет двигаться к аноду, а в кислой — к катоду.
Величина pH, при которой степень диссоциации кислых и щелочных групп одинакова, называется изоэлектрической точкой. В этой точке белки обладают наименьшей растворимостью. В большинстве случаев изоэлектрическая точка находится в кислой среде при pH 4—6, при этом белок обладает наименьшей растворимостью и осаждение его происходит очень легко.
Молекулы белка представляют собой длинные полипептидные цепи, образованные различными аминокислотами. Полипептидные цепи состоят из аминокислот, как структурных единиц, или из мономеров, которые объединяются в полимерную молекулу белка. Около 22 природных аминокислот входят в состав белков. Из 22 аминокислот можно сделать огромное число сочетаний и построить бесчисленное количество разнообразных белков.
Биосинтез белка является одной из важнейших проблем современной биохимии, которая привлекает внимание многих химиков, биохимиков и физиков. Эта проблема имеет огромное теоретическое и практическое значение. Биосинтез белков осуществляется в рибосомах с помощью информационной РНК.
Белки состоят из остатков аминокислот, соединенных между собой пептидными связями и образующих полипептидные цепи. Впервые на наличие пептидной связи (—СО — NH2) в молекуле белка указал русский ученый Л. Я. Данилевский.
В 1961 г. Э. Фишер осуществил синтез аланилаланина и показал, как связаны аминокислоты между собой в молекуле дипептида: 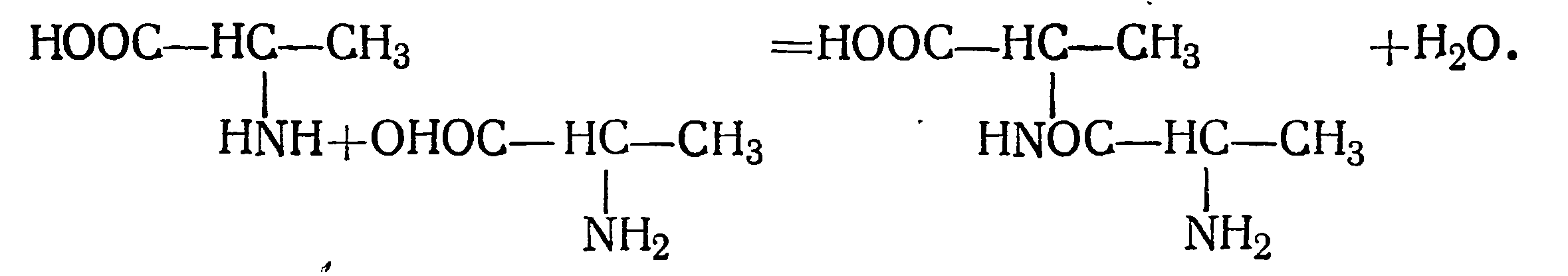
Однако наибольшие успехи в определении структуры полипептидов белков были достигнуты за последние годы, когда были установлены структуры нескольких белков разной молекулярной массы.
По данным Л. Полинга и Р. Кори, полипептидные связи располагаются в белковой глобуле белка в виде спирали, отдельные цепи которых соединены между собой водородными связями, благодаря чему сохраняется спиральная α-структура. Помимо водородных связей, существуют дисульфидные, ионные, а также гидрофобные, которые располагаются в пространстве. При этом они имеют соответствующую конформацию. В зависимости от характера связей и степени спирализации полипептидной цепочки и расположения ее в пространстве различают первичную, вторичную, третичную и четвертичную структуру белковой молекулы.
Под первичной структурой следует понимать число и последовательность остатков аминокислот, связанных пептидными связями. В белках с большей молекулярной массой имеются и другие факторы, приводящие к образованию вторичной, третичной и четвертичной структур, в значительной степени влияющих на химические и физические свойства. Вторичная структура белка характеризуется водородными связями между полипептидными цепочками, в результате возникает спиральная структура молекулы. Третичная структура основана на дисульфидных связях, т. е. на связях между двумя половинами остатков цистина. В четвертичной структуре содержится несколько полипептидных связей, соединенных между собой водородными, ионными или солевыми связями — это так называемые гидрофобные связи.
Структура белковой молекулы определяет биологические свойства белка — его ферментативную активность.
Белки делят на две группы: протеины, или простые белки, и протеиды — сложные белки. В состав протеинов входят только остатки аминокислот. К ним относятся альбумины, глобулины, глютамины, проламины, глютелины, гистоны. Протеиды являются сложными соединениями протеинов с другими веществами небелковой природы. Обычно небелковый компонент называют простетической группой, и в зависимости от ее химического состава различают следующие протеиды: гликопротеиды (в состав простетической группы входит углевод), липопротеиды (простетическая группа является жироподобным веществом), нуклеопротеиды (белок связан с нуклеиновой кислотой, играющей важную роль в жизнедеятельности организма, в частности в явлениях наследственности).
Следует считать, что к протеидам относятся и ферменты винограда, которые имеют большое значение в биохимии и технологии вина.
Белки винограда и вина в основном представлены протеидами, большинство которых обладает ферментативной активностью. К числу таких протеидов относятся гликопротеиды, в углеводную фракцию которых входят глюкоза, фруктоза, манноза, ксилоза, галактоза, рамноза и фукоза.
Исследования, проведенные в последние годы, показали, что в белковую молекулу ягод винограда входят 18 аминокислот [98]. В табл. 2 приведено содержание аминокислот в гидролизатах белка пяти сортов винограда.
Таблица 2
КОЛИЧЕСТВО АМИНОКИСЛОТ В БЕЛКАХ ВИНОГРАДА РАЗНЫХ СОРТОВ
(В МГ/КГ)
Аминокислота | Каберне | Гричнолино | Мальвазия | Рислинг | Семильон |
α-Аланин | 10,4 | 9,7 | 7,8 | 10,1 | 11,7 |
β-Аланин | 3,8 | 2,9 | 3,7 | 1,9 | 1,5 |
Аргинин | 1,1 | 0,7 | 0,9 | 0,6 | 0,9 |
Аспарагиновая | 15,8 | 17,6 | 18,0 | 15,7 | 18,3 |
Цистеин | 2,9 | 2,5 | 2,2 | 1,7 | 1,5 |
Глютаминовая кислота | 10,5 | 10,0 | 9,7 | 11,2 | 11,0 |
Глицин | 9,5 | 8,6 | 8,3 | 8,0 | 8,9 |
Гистидин | 1,1 | 0,7 | 1,0 | 0,6 | 7,0 |
Изолейцин | 2,2 | 2,1 | 1,4 | 2,4 | 2,0 |
Лейцин | 4,2 | 4,3 | 4,1 | 5,0 | 6,1 |
Лизин | 1,6 | 1,8 | 0,9 | 1,3 | 1,4 |
Метионин | 0,2 | 0,2 | 0,2 | 0,6 | 0,6 |
Фенилаланин | 2,7 | 2,9 | 2,8 | 4,3 | 4,7 |
Пролин | 3,3 | 3,4 | 6,9 | 7,8 | 3,4 |
Серин | 13,4 | 14,6 | 15,4 | 6,9 | 7,5 |
Триптофан | 4,7 | 8,6 | 9,2 | 12,0 | 12,0 |
Тирозин | 4,4 | 4,3 | 4,1 | 5,6 | 4,4 |
Валин | 3,3 | 3,6 | 3,2 | 4,3 | 3,4 |
В белках винограда в наибольшем количестве встречаются α- аланин, аспарагиновая и глютаминовая кислоты, серин и триптофан, в наименьшем — аргинин, гистидин и метионин.
Белковые вещества винограда довольно разнообразны и содержат несколько фракций. Первые исследования по изучению гетерогенности белков винограда были проведены В. Димайером и И. Кохом методом электрофореза в 1962 г. Согласно их данным белки состоят из нескольких фракций, причем две из них являются главными, по отношению к теплу одна фракция является лабильной.
Р. Моретти и X. Берг (1965) методом электрофореза на полиакриламидном геле в присутствии трисглицеринового буфера с pH 8,3 разделили белок виноградного сока на пять фракций. Молекулярная масса выделенных фракций колебалась от 18 000 до 23 000D, изоэлектрическая точка белка варьировала от pH 3,5 до pH 3,7.
Более глубокие исследования были проведены Е. Н. Датунашвили и Η. М. Павленко [23]. Они осаждали белки сульфатом.
аммония, а затем фракционировали на колонке с сефадексом. Из виноградного сока были выделены фракции, обладающие ферментативной активностью. Исследования показали, что белок, выделенный из винограда, гетерогенен. При электрофорезе на геле агара он делится на 4—5 фракций, а в геле полиакриламида — на 7—16. Показано также, что в препарате белка сорта Мускат александрийский содержится 6% протеина, связанного с гексозой, а в препарате белка сорта Семильон— 12,5%.
Методом электрофокусировки белков в полиакриламидном геле были определены изоэлектрические точки отдельных фракций белков винограда сорта Мускат александрийский. В большинстве случаев изоэлектрическая точка находится в зоне pH от 3,0 до 7,1.
Согласно данным Е. Н. Датунашвили и др., белки винограда имеют относительно невысокую молекулярную массу. Низкомолекулярные фракции обладают молекулярной массой около 10 000, а более высокомолекулярные от 24 000 до 47 000D [26].
При переработке винограда содержание белковых веществ изменяется в зависимости от технологии. Сусло, полученное прессованием, содержит больше белков, чем сусло, полученное самотеком.
Тепловая обработка виноградного сока и вина вызывает некоторое уменьшение белкового азота. Наши исследования показали, что обработка вина бентонитом значительно снижает содержание белков. При брожении сусла содержание белков заметно уменьшается.

