Схемы микробиологического контроля.
Систематический микробиологический контроль необходим, так как он помогает выявить очаги инфекции и вовремя ликвидировать их, дает возможность обнаружить начало заболевания виноматериалов до появления в них химических и дегустационно-уловимых изменений. Следует проводить его в тесной связи с химическим контролем, что дает возможность следить за нормальным ходом технологического процесса, выяснить причины, тормозящие или способствующие развитию микроорганизмов, распознавать источники инфекции.
В задачи микробиологического контроля входят два основных положения: наблюдения и оценка микробиологических процессов в сусле, виноматериалах, в вине как в процессе брожения, так и при хранении и выдержке; установление порядка ухода за инфицированными виноматериалами и винами, обработка больных вин.
Микробиологический контроль ведут в соответствии со следующими инструкциями (табл. 2): “Инструкцией по микробиологическому контролю винодельческого производства; ИК 10-04-05-40-89” и “Инструкцией по микробиологическому контролю производства Советского шампанского; ИК 10-04-05-11-87”.
Таблица 2. СХЕМЫ МИКРОБИОЛОГИЧЕСКОГО КОНТРОЛЯ ПРОИЗВОДСТВА ВИНОГРАДНЫХ ВИН, ОБОРУДОВАНИЯ, ТЕХНОЛОГИЧЕСКОЙ ТАРЫ И ВСПОМОГАТЕЛЬНЫХ МАТЕРИАЛОВ.
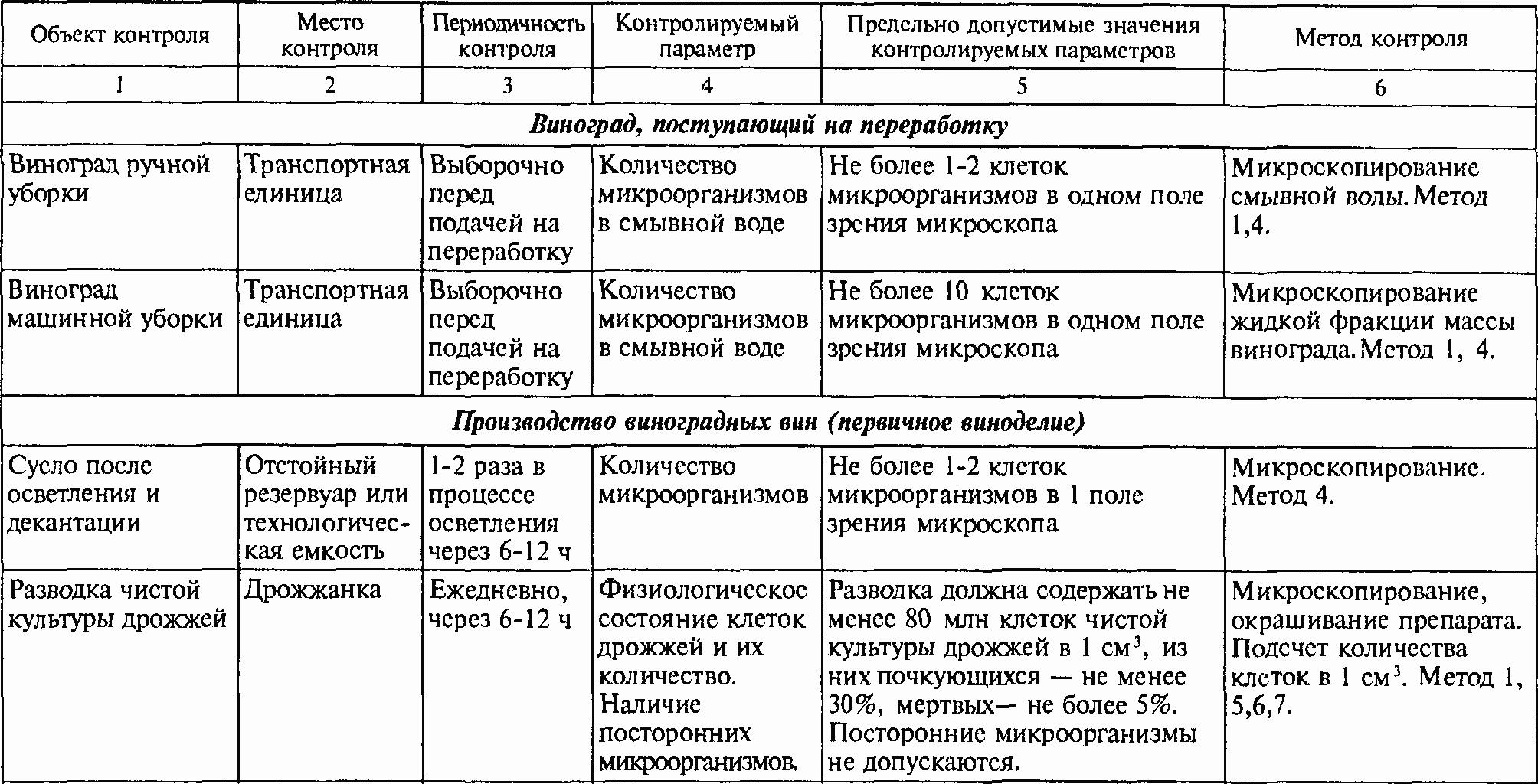
Продолжение таблицы 2
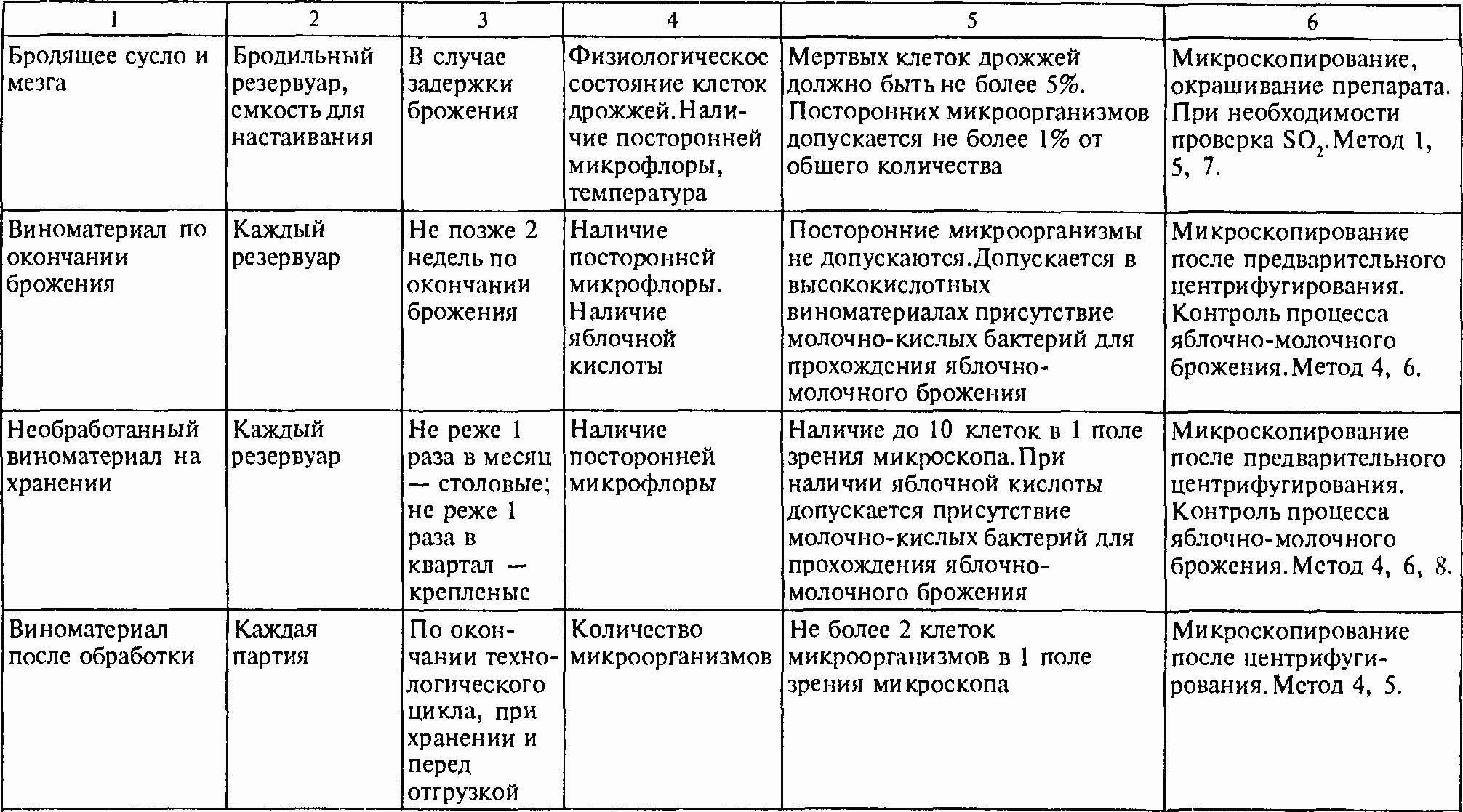

Продолжение таблицы 2
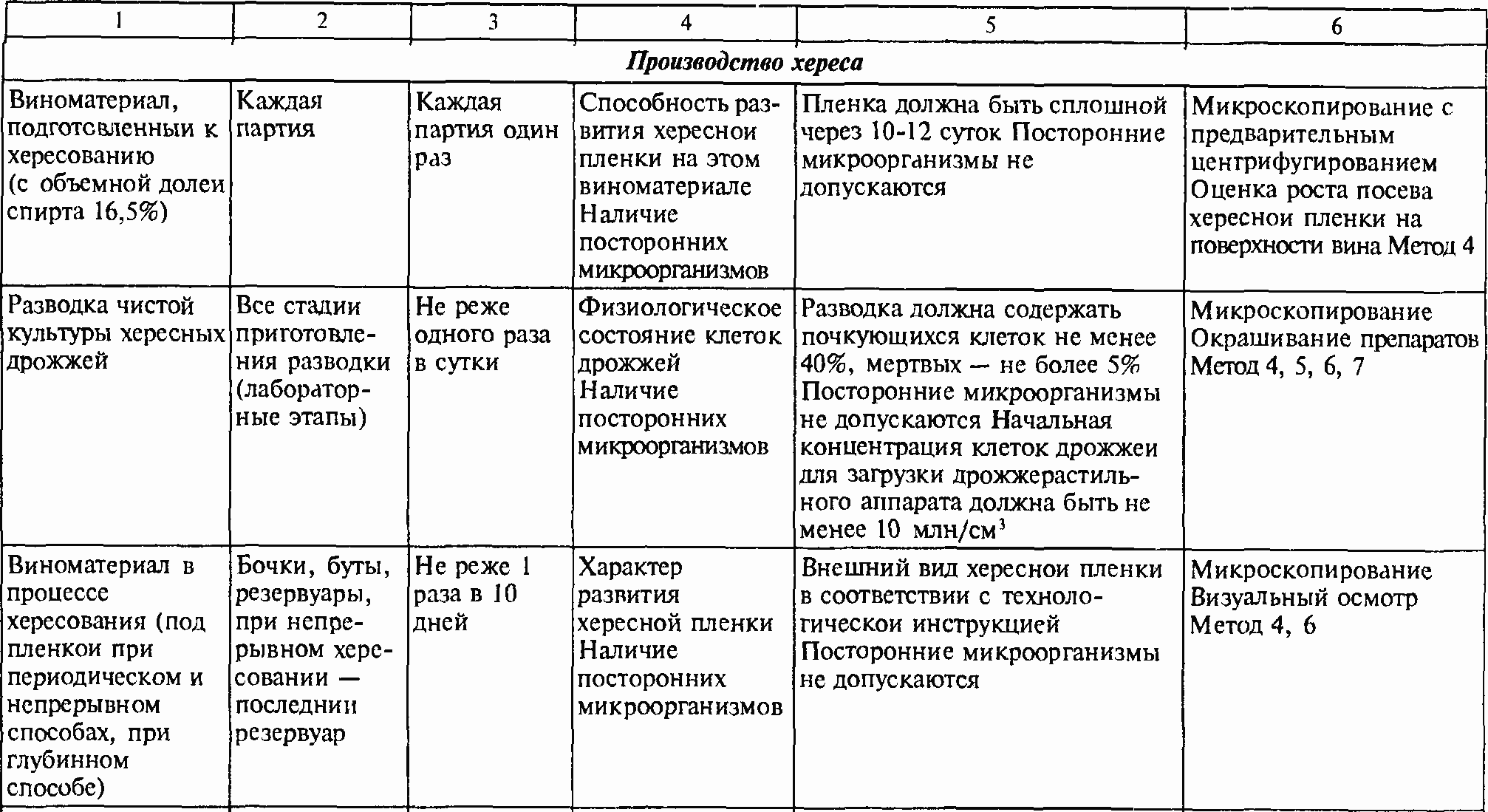

Продолжение таблицы 2.


Окончание таблицы 2

Таблица 3

Остальные вспомогательные материалы анализируются микробиологом в случае необходимости при входном контроле
Таблица 4 КОНТРОЛЬ ОБОРУДОВАНИЯ И ТЕХНОЛОГИЧЕСКОЙ ТАРЫ
12 Справочник

Методы микробиологического контроля.
Разнообразие контроля микрофлоры в виноделии сводится, в основном, к трем группам определений:
определение общего количества тех или иных микроорганизмов:
определение систематических групп состава микроорганизмов;
определение физиологического состояния микроорганизмов.
Третья группа определений, важная для характеристики состояния сусла или вина, иногда недооценивается при микробиологическом контроле, в то время как этот показатель должен быть ведущим в назначении технологических операций.
Отбор пробы винограда. При контроле на обсемененность микроорганизмами винограда ручной уборки для анализа отбирают с разных мест транспортной единицы 50 ягод, помещают их в широкогорлую колбу на 500 см3 со 100 см3 стерильной водопроводной воды, тщательно взбалтывают в течение 3—5 минут. Для микроскопирования готовят препарат смывной воды.
- Отбор пробы виноматериала, вина. От однородной партии виноматериала отбирается средняя проба, а в случае необходимости — из каждой отдельной емкости, в соответствии с предусмотренными правилами приемки и отбора проб. При необходимости проведения анализа методом посева на питательные среды проба отбирается с соблюдением правил стерильности.
Если виноматериал длительное время находился в состоянии покоя, пробы отбирают из нескольких слоев, в том числе и из осадка. Для этого пользуются резиновыми шлангами с зажимами и со стеклянной трубкой или пробоотборниками, которые после каждого отбора пробы промывают чистой водой, а затем — исследуемым виноматериалом. После отбора проб из инфицированных виноматериалов шланги и пробоотборники следует ополаскивать водой, затем спиртом и пользоваться ими не ранее, чем через 5 минут. В случае необходимости отбора проб из нижнего крана предварительно пропускают через него 5—10 дм3 виноматериала. Вино, находящееся в бутылке, перед отбором пробы тщательно взбалтывают и чистой сухой пипеткой отбирают из середины бутылки пробу.
Микробиологический анализ проб проводят как можно быстрее после отбора, не позднее, чем через 2 ч при условии хранения образцов при температуре 6±ГС, при определении количественного состава микрофлоры — не позднее, чем через 30 мин.
- Предварительная оценка микробиологического состояния виноматериалов. Предварительный ориентировочно-экспрессный способ оценки основан на определении степени обсемененности виноматериалов микроорганизмами, развивающимися в них: дрожжами, молочно-кислыми и уксусно-кислыми бактериями. Общее число клеток микроорганизмов определяют микроскопированием отобранной пробы или микроскопированием после центрифугирования.
Для определения количества клеток микроорганизмов в 1 см3 виноматериала производят подсчет в счетной камере (метод 5). Ориентировочное определение систематических групп микроорганизмов проводится по морфологическому признаку при микроскопировании.
При текущих микробиологических исследованиях в производственных условиях допускается ориентировочно-экспрессная оценка состояния виноматериалов (табл. 5) с использованием при микроскопировании препаратов “раздавленная капля” и с учетом химических и органолептических показателей.
Виноматериал, оцененный как “больной”, немедленно обрабатывают по схеме: пастеризация не менее 10 мин, фильтрация и сульфитация до массовой концентрации 25—30 мг/дм3 SO2 свободной. Обработанные таким образом виноматериалы подвергаются через сутки тщательному микробиологическому контролю и используются в производстве по заключению дегустационной комиссии.
- Оценка устойчивости виноматериалов и вин к микробиальным помутнениям. Микробиологическое состояние виноматериалов проверяют после каждой обработки, а виноматериалы, находящиеся на выдержке и хранении, — не менее одного раза в месяц.
Основным методом оценки микробиологической стойкости виноматериалов и вин является определение времени развития микроорганизмов в отобранной пробе, в элективных питательных средах и микроскопирование (табл. 6).
Таблица 5. ЭКСПРЕСС-ОЦЕНКА МИКРОБИОЛОГИЧЕСКОГО СОСТОЯНИЯ ВИНОМАТЕРИАЛОВ

Таблица 6. ОЦЕНКА МИКРОБИОЛОГИЧЕСКОЙ СТОЙКОСТИ ВИНОМАТЕРИАЛОВ И ВИН
Оценка | Время развития микроорганизмов, сутки | ||||
Рост в пробирке с виноматериалом, вином | Рост молочно-кислых бактерий при посеве виноматериала, вина на питательную среду | ||||
дрожжей | уксуснокислых бактерий или смеси уксуснокислых бактерий и дрожжей | ||||
винных | диких (пленчатых) | с сорбиновой кислотой | с этанолом | ||
Больной | — | 1 | 1-2 | 3 | 3 |
Нестойкий | 1-3 | 1-3 | 3-5 | 4-6 | 4-15 |
Стойкий | 4 и более | 4 | 6 и более | 7 и более | более |
Примечание: Развитие молочно-кислых бактерий при анализе высококислотных виноматериалов и вин свидетельствует о прохождении яблочно-молочного брожения.
Виноматериалы и вина, инфицированные дрожжами и уксусно-кислыми бактериями, выявляют по времени развития их в отобранной пробе. Для этого исследуемую пробу (10 см3) в стерильной пробирке с ватной пробкой помещают в термостат с температурой 26±1 С.
Виноматериалы и вина, инфицированные молочно-кислыми бактериями, выявляют по времени развития их после посева на элективные питательные среды. Исследуемую пробу в количестве 0,5 см3 высевают в одну из питательных сред для молочно-кислых бактерий: с сорбиновой кислотой или с этанолом.
В качестве питательных сред используются солодовое сусло, яблочно-солодовое сусло, разбавленное виноградное сусло, капустная среда. Элективные для молочно-кислых бактерий условия создаются добавлением в среду непосредственно перед посевом до объемной доли этилового спирта 14% (0,95 см3 на 5 см3 среды).
Можно использовать также сочетание действия сорбиновой кислоты, подавляющей рост дрожжей, с созданием анаэробных условий для предотвращения развития уксусно-кислых бактерий. Используют сорбат натрия с массовой концентрацией 5 г/100 см3 из расчета 0,2 см3 на 10 см3 вина. Посевы культивируют при температуре (26±1)°С.
Пригодность виноматериала, подготовленного для хересования, определяют по времени развития хересной пленки. Исследуемый виноматериал в количестве 10 см3 вносят в стерильную пробирку с ватной пробкой и высевают на его поверхность петлей чистую культуру хересных дрожжей. Культивирование ведут при комнатной температуре.
“Больным” или “нестойким” считается виноматериал или вино, в котором обнаружен рост хотя бы одного из указанных в таблице 6 микроорганизмов.
Косвенным показателем больного вина является массовая концентрация летучих кислот, превышающая допустимую, а также посторонние тона при органолептической оценке.
Виноматериал, оцененный как “больной”, “нестойкий”, обрабатывают по схеме, приведенной в главе “Стабилизация виноградных вин”.
Виноматериалы с высокой титруемой кислотностью и наличием молочно-кислых бактерий проверяют методом хроматографии на наличие яблочной кислоты. При обнаружении яблочной кислоты решается вопрос об оставлении виноматериалов для отдельных типов вин до окончания яблочно-молочного брожения или предотвращения этого процесса (например, пастеризацией).
Виноматериал, в котором проходит биологическое кислотопонижение, подвергают микробиологическому и химическому контролю не реже одного раза в 10 дней.
О начале яблочно-молочного брожения свидетельствует резкое увеличение количества бактерий, снижение массовой концентрации титруемых кислот, повышение массовой концентрации летучих кислот. Завершается этот процесс в течение 20 сут. и более, в зависимости от температуры и содержания SO2 в вине. Об окончании процесса яблочно-молочного брожения судят по уменьшению пятен яблочной кислоты на хроматограмме. По окончании процесса инактивируют бактерии (сульфитация 30—50 мг/дм3 свободного SO2, пастеризация), затем проводят оклейку и фильтрацию.
Для получения биологически стабильных вин завод может использовать любые режимы и виды обработки в соответствии с утвержденными технологическими инструкциями.
- Микроскопирование. Для микроскопирования готовят препарат “раздавленная капля”. На предметное стекло наносят каплю исследуемой жидкости и накрывают покровным стеклом.
При микроскопировании с предварительным центрифугированием 10 см3 исследуемого материала центрифугируют при частоте вращения 50с-1 (3,0-103 об/мин) 5 мин. Надосадочную жидкость сливают и готовят препарат. При микроскопировании лучше пользоваться объективом 40х и окуляром 10х или 15х.
Метод прижизненного окрашивания предназначается для дифференциации живых и мертвых клеток дрожжей при микроскопировании. На предметном стекле смешивают каплю исследуемой жидкости с каплей раствора красителя метиленовая синь. Мертвые клетки окрашиваются в цвет красителя.
При приготовлении раствора красителя метиленового синего 3 г красителя растворяют в 100 см3 этилового спирта с объемной долей 96%. Через 2—3 дня из него готовят с дистиллированной водой разведения в соотношении 1:10, 1:40. Растворы нестойкие, их следует хранить укупоренными, в прохладном, защищенном от света месте.
Микроскопирование позволяет установить форму и размер клеток дрожжей и бактерий, их физиологическое состояние и наличие механических и биологических загрязнений, т. е. посторонних микроорганизмов.
Появление в культуре (препарате) клеток другой формы, резко отличающихся от обычных, свидетельствует об инфицировании.
- Определение общего количества клеток микроорганизмов. Метод подсчета клеток в счетной камере. Для определения концентрации (числа клеток) микроорганизмов в 1 мл жидкости производят подсчет их под микроскопом в счетной камере (Тома- Цейса, Горяева, Бюркера или Предтеченского). В каждом препарате счетной камеры, например, Тома-Цейса, подсчитывают клетки в 5-ти больших квадратах — по углам и в центре сетки. Густые суспензии следует разбавлять водой с таким расчетом, чтобы количество клеток в одном большом квадрате было не более 30. Для того, чтобы результат подсчета был достоверен, необходимо сосчитать не менее 600 микроорганизмов.
Чтобы определить количество клеток в 1 мл исследуемого субстрата, нужно в зависимости от количества препаратов среднюю сумму клеток в 5 больших квадратах или сумму клеток в 5 больших квадратах умножить на 50000. Удобно пользоваться формулой:
X = а · 50000 · б,
где а — сумма клеток пяти больших квадратов;
б — разведение исходной суспензии микроорганизмов;
50000 — коэффициент пересчета объема пяти больших квадратов на 1 см3.
Полученные данные выражают в млн/см3.
При дифференцированном подсчете почкующихся живых и мертвых клеток дрожжей на сетку помещают каплю исследуемой суспензии, добавляют каплю водного раствора метиленовой синей (1:10000), перемешивают, накрывают покровным стеклом, притирают его. Через 5 мин. после приготовления препарата подсчитывают отдельно количество почкующихся живых и мертвых клеток (окрашенных в синий цвет). Подсчитывая результаты, следует учитывать разбавление вдвое красителем.
Метод прямого счета клеток микроорганизмов в поле зрения микроскопа. Подсчитывают количество микроорганизмов в 10 полях зрения микроскопа препарата “раздавленная капля”, передвигая препарат по диагонали. Затем вычисляют среднее количество клеток в одном поле зрения. При необходимости определения количества клеток в 1 см3 расчет производят по формуле, используемой при подсчете в счетной камере. Однако это ориентировочный подсчет.
Этим методом пользуются при определении группового количественного и качественного состава микроорганизмов. Подсчитывают в каждом поле зрения отдельно количество винных дрожжей, диких дрожжей, бактерий, спор плесневых грибов, и на основании полученных данных подсчитывают общее количество микроорганизмов в одном поле зрения и процентное соотношение каждой группы.
- Микроскопический анализ. Проводится при микроскопировании препарата “раздавленная капля” и включает изучение морфологических и культуральных признаков микроорганизмов.
Часто препараты бывают непрозрачны, и посторонние микроорганизмы, особенно бактерии, остаются в них неразличимыми. Под действием 10-процентного раствора щелочи белковые слизеобразные вещества растворяются, заключенные в них бактерии освобождаются и получается прозрачный препарат с равномерно рассеянными дрожками и бактериями. Вместо щелочи можно применять разбавленную 50%-ную или 10%-ную соляную кислоту.
Краткая характеристика основных групп микроорганизмов винодельческого производства приведена в первой части главы.
Дикие дрожжевые клетки, находящиеся в микроскопическом препарате вместе с винными дрожжами сахаромицетами, хорошо распознаются благодаря их характерной удлиненной форме, имеют иногда менее зернистую и более ясную протоплазму, чаще в виде единичных клеток или ветвеобразного скопления.
Метод окраски по Граму. Этот важный диагностический признак дает возможность различить уксусно-кислые и молочно-кислые бактерии, обычно трудно различимые при микроскопировании.
При правильном окрашивании препарата грамположительные микроорганизмы имеют сине-фиолетовый цвет, грамотрицательные — красный цвет фуксина. Из микроорганизмов, развивающихся в сусле и в вине, красятся по Граму — грамположительные дрожжи и молочно-кислые бактерии; не красятся по Граму — грамотрицательные уксусно-кислые бактерии (подробно метод описан в практических руководствах по микробиологии).
- Определение физиологического состояния клеток дрожжей. В цикле развития дрожжей различают семь стадий: размножение, брожение, голодание, стадию покоящихся клеток, спорообразование, отмирания и автолиз.
Размножение характеризуется усиленным почкованием клеток. Почка — дочерняя клетка, достигнув определенных размеров, отделяется от материнской. При благоприятных условиях полное развитие клетки заканчивается приблизительно за час. Эта стадия характеризуется наличием большого количества почкующихся клеток с однородной плазмой и тонкой оболочкой.
В период активного размножения количество мелких клеток возрастает при лимите в питательной среде стимуляторов роста, питательных веществ и уменьшается при повышении температуры. Это дает информацию о возможных нарушениях технологического процесса.
Брожение. В этой стадии дрожжи в преобладающем большинстве находятся в виде отдельных клеток, имеют зернистую плазму, мелкие вакуоли, большой запас питательных веществ (гликогена, жира). При окрашивании раствором йода в йодистом калии клетки приобретают красно-бурый цвет — реакция на гликоген.
Голодание. После сбраживания сахаров дрожжи оседают на дно, жизнедеятельность продолжается за счет запасного гликогена. Клетки становятся мельче, протоплазма приобретает зернистость, оболочка утолщается. Окрашиваются йодом в желтый цвет.
Отмирание клеток наступает при длительном хранении дрожжевого осадка в вине при недостатке или отсутствии кислорода воздуха. Оно характеризуется отставанием плазмы от своеобразного зеленого цвета утолщенной оболочки. Отмершие клетки кажутся сильно деформированными и окрашиваются метиленовой синькой в синий цвет.
Разложение. В процессе распада у отмерших клеток вначале набухает оболочка, плазма приобретает крупнозернистое строение. Оболочка разрывается, содержимое клетки переходит в вино, образуя тончайшую трудноустранимую муть.
Автолиз — это разложение компонентов клетки под действием своих же гидролитических ферментов. Происходит распад белков, углеводов, нуклеотидов, липидов и других веществ клетки и выход их составных частей в среду. Необходимым условием автолиза является отмирание клеток при сохранении активности внутриклеточных ферментов.
Покоящиеся клетки наблюдаются при долгом пребывании дрожжей в осадке вина с доступом кислорода воздуха. В таких условиях за счет органических кислот клетки могут образовать одну или несколько почек. Имеют плотную оболочку. Они могут переносить отсутствие питательных веществ и более высокую температуру.
Спорообразование наступает у дрожжей при резком неблагоприятном изменении условий питания, при достаточной влажности и доступе кислорода воздуха. Образование спор — второй способ размножения. Попадая в благоприятную питательную среду, споры набухают, разрывают оболочку клетки и почкуются.
- Метод бумажной хроматографии для контроля процесса яблочно-молочного брожения. Реактивы: 1. Растворитель — н-бутиловый спирт, муравьиная кислота 85%-ная, вода (4:1:5). Смесь взбалтывают 10—15 мин в делительной воронке или колбе и оставляют на сутки для расслаивания. Верхний слой используют для хроматографирования.
2. Проявитель — 0,05%-ный раствор бромфенолового синего в этиловом спирте ректификованном с объемной долей 96%. На каждые 250 см3 проявителя добавляют 2 см3 раствора NaOH молярной концентрацией 0,1 моль/дм3.
Для приготовления свидетелей — чистых растворов винной, яблочной и лимонной кислот — по 30 мг кислоты растворяют в 5 см3 спирта. Для приготовления раствора молочной кислоты 1—2 капли 50%-ной молочной кислоты растворяют в 5 см3 этилового спирта.
Используются хроматографическая бумага № 1 — ленинградская или фильтровальная, эксикатор (диаметром 20 см и больше) и капилляры или микропипетки для нанесения капель. При отсутствии капилляров и микропипеток можно использовать петлю из проволоки нержавеющей стали диаметром 0,5 мм. Такой петлей наносят 0,7 см3 испытуемого материала.
Из бумаги вырезают круг по диаметру эксикатора. На бумаге описывают круг диаметром 2 см, на котором отмечают точки на расстоянии 1,5 см одна от другой. В отмеченные точки (положив под круг бумаги что-нибудь твердое) наносят капиллярами вина и растворы свидетелей. Размер пятна на бумаге должен быть не более 3 мм. Каждую последующую каплю наносят после высыхания предыдущей. Свидетели наносятся 5—6 раз, исследуемое вино 7—8. После подсушивания в центр круга вставляют фитилек из хроматографической бумаги и круг помещают в эксикатор, где находится чашка Петри с растворителем. Свободный конец фитилька помещают в растворитель, эксикатор герметически закрывают крышкой. Когда растворитель пройдет по радиусу расстояние 7—8 см от центра, разделение считают законченным. Обычно это происходит за 50—60 мин. Затем бумагу извлекают, высушивают в вытяжном шкафу до исчезновения запаха муравьиной кислоты и опрыскивают раствором проявителя из пульверизатора.
Кислоты располагаются по радиусу в следующем порядке: винная, яблочная, янтарная и молочная.
Для идентификации пятен кислот на бумаге отмеряют циркулем расстояние по радиусу от точки нанесения капли до начала пятна. Полученное расстояние сравнивают с расстоянием, пройденным свидетелем. Идентичные кислоты проходят одинаковое расстояние.
- Микробиологический контроль воздуха. Микробиологическое исследование воздуха проводят седиментационным методом, основанным на оседании микробных клеток на поверхности агара в открытой чашке Петри.
Метод описан в “Инструкции по микробиологическому контролю Советского шампанского” — ИК 10-04-05-11-87 и в “Инструкции по микробиологическому контролю винодельческого производства” — ИК 10-04-05-40-89.

