Б. Ц. Зайчик, А. О. Ружицкий, В. П. Хотченков, И.В. николаев, О. в. Королева
Институт биохимии им. А. Н. Баха РАН
С. С. Щербаков
РГАУ—МСХА им. К. А. Тимирязева
Ключевые слова: коньяк, качество, кластерный анализ, метод главных компонент
Key words: brandy, quality, cluster analysis, principal components method
Развитие технологий производства алкогольных напитков, значительное расширение ассортимента и включение в технологическую схему производства вспомогательных материалов (красители, ароматизаторы, консерванты, растительные экстракты) делает насущной проблему контроля качества и аутентичности винодельческой продукции, в том числе коньяков.
Понятие качество для коньячной продукции, как и для любого пищевого продукта, определяется соответствием характеристик продукта определенным критериям, среди которых можно выделить технологию производства продукта, органолептические и физико-химические характеристики конечной продукции.
Качественным коньяком можно считать продукт, соответствующий нормативной документации, с характерным набором маркеров и удовлетворительной органолептической оценкой [1].
В международной практике при анализе крепких алкогольных напитков изучают достаточно широкий спектр физико-химических характеристик: в частности, критериями качества продукции выступает содержание различных добавок, антиоксидантов, маркеров подлинности (соотношение изотопов различных элементов, количество биофлавоноидов и др.) [2-5]. К тому же современные международные тенденции показывают, что помимо контроля качества необходим и контроль безопасности продукции. Применение современных методов анализа в Российской Федерации несколько ограничено в силу недостаточного распространения современных инструментальных методов. Но даже при наличии оборудования требуются отработанные протоколы анализа продукции, а также установление взаимосвязей между ними и традиционно используемым при оценке органолептическим тестированием.
Набор показателей, необходимый для установления качества коньяка, в настоящее время определяет соответствующая нормативная документация, но ее, к сожалению, недостаточно для точного установления аутентичности продукции.
Выбор дополнительных маркеров обусловлен ключевыми стадиями производства коньячной продукции: приготовление коньячных виноматериалов, получение коньячных спиртов, их выдержка и приготовление коньяков [6].
Получают коньячные спирты путем дистилляции, и, значит, основную роль играют летучие вещества, впоследствии формирующие аромат готового продукта. Обычно для анализа летучих веществ используют газохроматографические методы.
Отличительная особенность коньячного производства — выдержка коньяка в дубовых бочках, где происходят экстракция фенольных соединений и трансформация лигнина. Для изучения продуктов, переходящих в коньяк на этой стадии, можно использовать различные методы, в том числе метод определения антиоксидантной емкости (АОЕ). Ее можно считать маркером качества, поскольку продукция, полученная без нарушений технологических инструкций, должна обладать достаточно высокой АОЕ в связи с наличием в ее составе широкого спектра фенольных компонентов, являющихся продуктами многоступенчатого процесса трансформации лигнина и танинов дуба и переходящих в коньяк в процессе выдержки с образованием физиологически активных соединений. Пример таких соединений — ароматические альдегиды (синаповый, конифериловый, сиреневый и ванилин), которые, по данным исследователей, могут служить маркерами возраста и качества коньячной продукции [7-10].
Для оценки содержания ароматических альдегидов можно использовать высокоэффективную жидкостную хроматографию либо капиллярный электрофорез [11-14]. Исследования коньячной продукции, проведенные в последние годы, дают представление о составе коньяка, но не дают возможности оценить качество образца.
Таким образом, цель настоящей работы — выбор критериев для оценки качества коньячной продукции и определение корреляций между физико-химическими параметрами и органолептическим тестированием.
Условия эксперимента.
Объектами для исследования служили 112 образцов коньячной продукции отечественных и зарубежных производителей, отобранные из розничной сети. Данные о производителе и возрасте коньяка взяты с этикеток соответствующих образцов, то есть они заявлены производителями и проверке не подвергались.
Водородный показатель (рН) коньяка определяли на рН-метре Checkery Hanna (Германия) с комбинированным стеклянным микроэлектродом, предварительно откалиброванным по стандартным буферным растворам. Антиоксидантную емкость коньяка по отношению к пероксильному радикалу (Oxygen Radical Absorbance Capacity ORAC-FL) находили по методике, разработанной B. Ou и сотр. [15], а по отношению к катион-радикалу ABTS (TEAC) — по методу, описанному в работе R. Re и сотр. Мы также провели оптимизацию самого метода [16-18].
Общее содержание фенольных соединений определяли с помощью реактива Фолина — Чокальтеу по методу V. L. Singleton с сотр. В качестве стандартов использовали галловую кислоту и тролокс. Результаты, нормированные на тролокс, позволяют сравнить их с показателями антиоксидантной емкости.
Ароматические альдегиды определяли методом капиллярного электрофореза на системе высокоэффективного капиллярного электрофреза (ВЭКЭ) «Beckman Coulter P/ACE MDQ Capillary Electrophoresis System». Полученные электрофореграммы автоматически обрабатывали и анализировали с помощью системы «32 Karat 8.0». Условия проведения электрофореза аналогичны условиям, указанным в работе Паносяна и сотр.
Состав летучих компонентов выявляли методом газовой хроматографии с использованием пробоподготовки в предложенной нами модификации, заключающейся в барботировании образца инертным газом с последующим криоконцентрированием летучих компонентов в ловушке, что позволяет отселектировать летучие компоненты, непосредственно участвующие в создании запаха коньяка [19, 20]. Хроматографическое разделение проводили на хроматографе Shimadzu GC 2010 с масс-детектором GCMS-QP-2010 [21].
Цветовые характеристики (интенсивность, оттенок, относительную яркость) определяли согласно рекомендациям МОВВ [22].
Органолептическую оценку проводили по 100-балльной системе, описанной Г. Г. Валуйко [23].
Для статистической обработки использовали программу Биостатистика и Microsoft Excel XP. Достоверными принимались различия при р < 0,05.
Анализировали полученные данные с помощью 2-этапного кластерного анализа и метода главных Результаты и обсуждение. Суть 2-этапного кластерного анализа состоит в разделении имеющегося массива экспериментальных данных на некоторое число типов различных кластеров с дальнейшим выделением наиболее информативных признаков кластеризации.
Цель проведения кластерного анализа — разделение образцов на группы с максимальными различиями между ними. При анализе предварительно приняли решение об использовании фиксированного числа кластеров (2): для разделения образцов на некачественные (кластер, или группа 1) и качественные (кластер, или группа 2). Достоверными различиями между группами считаются различия с р < 0,05. Доверительные интервалы по группам рассчитаны при α = 0,05.
На практике оценить для каждого образца такое количество параметров достаточно сложно, поэтому с помощью этого же анализа мы попытались выделить факторы, оказывающие наиболее существенное влияние на оценку качества коньяка и способные с наибольшей достоверностью служить маркером его аутентичности. Также необходимо учитывать, что измерения ряда параметров достаточно трудоемки и затратны (например, антиоксидантная емкость по протоколу ORAC-FL), а другую часть параметров можно считать методами экспресс-контроля. В связи с этим очень важен выбор оптимальных параметров контроля, учитывающих все факторы (временной, экономический и т. п.).
После просмотра различных комбинаций критериев, вводимых в качестве исходных параметров двухэтапного кластерного анализа, исходными данными были выбраны этиловый эфир октановой кислоты, антиоксидантная емкость по отношению к катион-радикалу ABTS, общее содержание фенольных соединений и интенсивность цвета (табл. 1).
Образцы разделены на группы согласно выбранным критериям (табл. 2) и определены средние значения выбранных параметров по кластерам (табл. 3).
В результате кластерного анализа все образцы были разделены на две группы, так что различие по этим группам по выбранным признакам достоверно.
Для верификации кластерного анализа провели дегустационную оценку образцов и разделили их на 2 группы. Коньяки, получившие более 85 баллов, условно признали аутентичными (n = 70, кластер 2), а набравшие 84 балла и менее названы фальсифицированными (n = 31, кластер 1).
Для каждого из разделений рассчитали средние значения дополнительных параметров и достоверность различий между ними по сформированным группам. В результате расчетов группы достоверно различаются по содержанию этилового эфира гексановой кислоты, показателям рН, АОЕ по методу ORAC, относительной яркости цвета, количеству сиреневого альдегида. А недостоверные различия наблюдаются по содержанию этилового эфира декановой кислоты, оттенку цвета и концентрации ванилина. Недостоверные отличия по оттенку можно объяснить тем, что цвет коньяка создается сахарным колером, а ванилин добавляется в некачественные коньяки для придания аромата.
Таким образом, можно сделать вывод, что по показателям оттенка и содержанию ванилина (кроме случаев, когда его количество настолько велико, что однозначно можно говорить об искусственном введении ванилина в напиток) нельзя судить о качестве продукции.
Сравнение средних значений по критериальным признакам в зависимости от разделения показало, что они очень близки между собой, и это дает возможность определить количественные границы качества по показателям.
Полученные значения выбранных критериальных признаков согласуются с данными литературы (в частности, по данным И. М. Скурихина, в аутентичных образцах содержится 300-550 мг/дм3 фенольных соединений). Значения антиоксидантной емкости сопоставимы с данными N. Pellegrini с сотр. (1290 мкмоль/дм3). При использовании коммерциализованного набора TAS RANDOX с ферментативной генерацией катион-радикала ABTS непосредственно в реакционной среде D. M. Goldberg и др. также получили сравнимые величины АОЕ коньяка (2500±300 мкмоль/дм3) [24].
Таблица 1
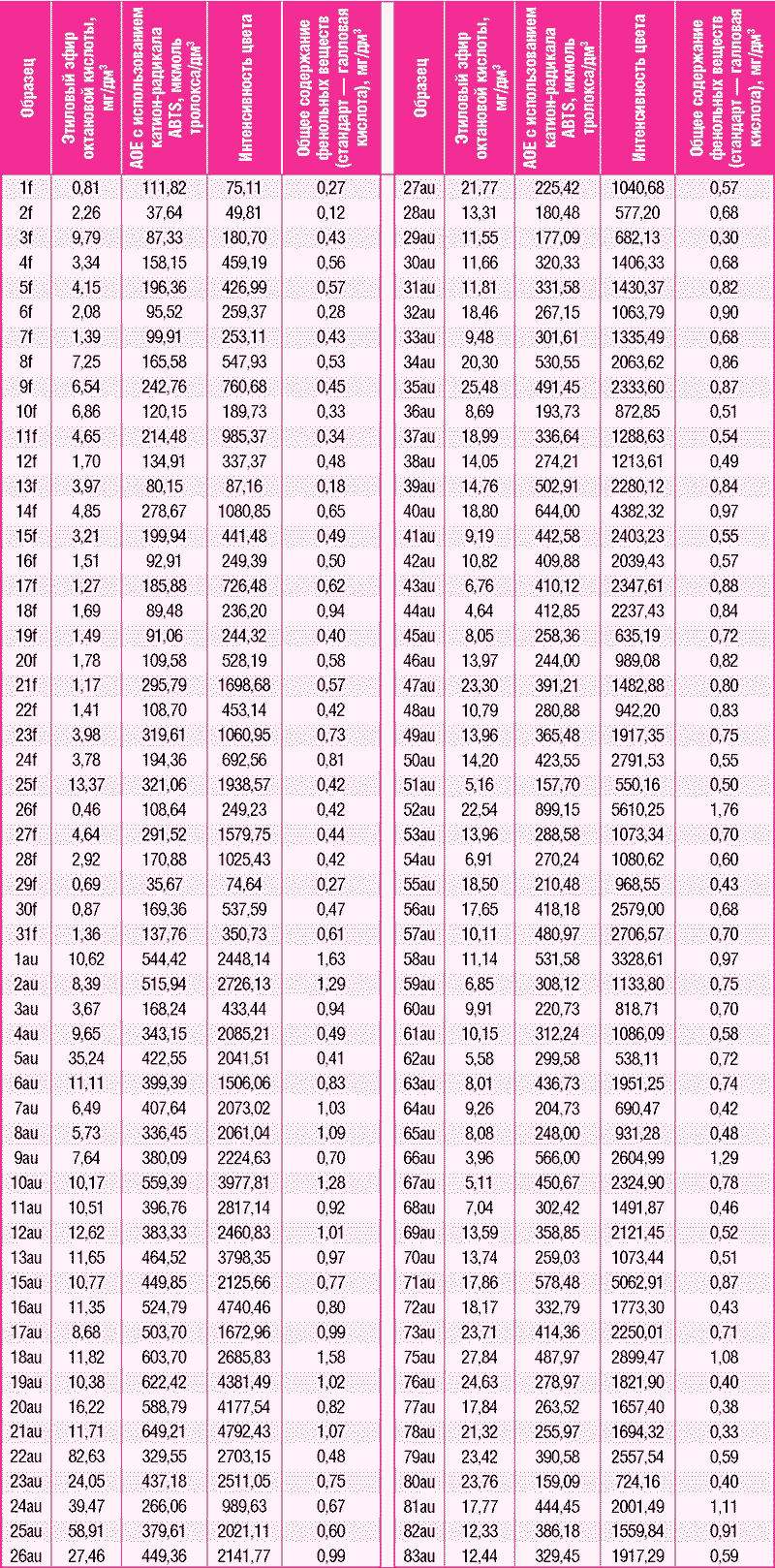
Для визуализации и сравнения данных разделения по кластерам и исходя из органолептической оценки анализировали полученные данные с использованием метода главных компонент.
Для анализа во всех случаях использовали два принципиальных компонента: с одной стороны, такого количества достаточно для описания большинства вариаций, а с другой, при увеличении числа принципиальных компонентов каждый следующий компонент затрудняет интерпретацию данных и вносит меньший вклад, чем предыдущий.
В качестве исходных данных в программу вводили таблицу (в строке — номера образцов, а в столбцах — полученные экспериментальные данные).
Возможность применения метода главных компонент для анализа коньячной продукции показана в работе Gomez-Cordovez C. и сотр. [26]. В качестве объективных характеристик использовали цветовые характеристики (интенсивность, оттенок), общее содержание фенольных веществ, количество катехинов и рН. Но этих параметров, по мнению Gomez-Cordovez C. и сотр., недостаточно для полной оценки качества продукта.
В качестве исходных данных дегустационную оценку не вводили. Полученный результат разделения образцов по результатам дегустационной оценки сравнивали с разделением образцов по соответствующим экспериментальным данным и результатами кластерного анализа.
Результаты анализа методом главных компонент по факторам антиоксидантной емкости с использованием катион-радикала АБТС, интенсивности цвета, общего содержания фенольных соединений и количества этилового эфира октановой кислоты покрывают 80,3 % вариаций и дают достаточное разделение между облаками. С другой стороны, измерение этих параметров не столь трудоемко, как, например, измерения антиоксидантной емкости по протоколу ORAC-FL, хотя при этом незначительно улучшается качество разделения облаков.
На построенной с помощью программы SPSS 17.0 диаграмме по результатам кластерного и органолептического разделения выделены аутентичные образцы, фальсифицированные и образцы, где результаты кластерного анализа не совпадают с органолептической оценкой. Все образцы достаточно четко разделились на 3 группы, причем образцы, у которых расходятся результаты кластерного анализа и органолептической оценки, занимают промежуточное положение между фальсифицированными и аутентичными образцами.
Таким образом, результат анализа методом главных компонент подтверждает значимую корреляцию данных инструментального анализа, дегустационной оценки и кластерного анализа как метода выбора критериев оценки аутентичности.
Результаты отнесения образцов к группам согласно кластерному и органолептическому разделениям отличались у 15 образцов, которые, в свою очередь, также можно разделить на 2 группы: 3 образца (21f, 25f, 27f) по результатам органолептического тестирования признаны фальсифицированными, а по результатам кластерного анализа — качественными, остальные 12 (3au, 28au, 29au, 36au, 45au, 51au, 54au, 59au, 60au, 62au, 64au, 65au) образцов находятся в обратной ситуации. Для установления их качества рассмотрены дополнительные параметры, не включенные в качестве критериев в кластерный анализ. Следует отметить, что дегустационная оценка этих 15 образцов тоже близка к границе между фальсифицированными и аутентичными образцами.
В результате у двух образцов (25f, 27f) из 1-й подгруппы фальсификацию можно подтвердить по значению рН и отсутствию сиреневого альдегида, два других образца по всем показателям находятся на границе между фальсификатами и аутентичными образцами (21f).
Для образцов, признанных аутентичными по результатам органолептического тестирования, но по результатам кластерного анализа отнесенных к группе некачественных после детального рассмотрения физико-химических характеристик, можно сделать следующие выводы: 59au, 62au из 12 образцов находятся на границе между фальсификатами и аутентичными, остальные справедливо отнесены к фальсифицированным по содержанию фенольных соединений (3au, 28au, 29au, 36au, 45au, 51au, 54au, 60au, 64au, 65au).
Таблица 2 | ||
Кластеры | | Кластерный анализ | | Органолептическое тестирование |
Группа 1 — некачественные образцы | 40 | 31 |
Группа 2 — качественные образцы | 72 | 81 |
Объединенный кластер | 112 | 112 |
Таблица 3
Профиль кластеров | Этиловый эфир октановой кислоты, мг/дм3 | АОЕ с использованием катион-радикала ABTS, мкмоль тролокса/дм3 | Интенсивность цвета | Общее содержание фенольных веществ (стандарт — галловая кислота), мг/дм3 |
Группа 1 (кластерный анализ) | 4,58±1,04 | 537,69±98,11 | 0,52±0,06 | 168,11±22,59 |
Группа 2 (кластерный анализ) | 15,27±2,92 | 2140,86±277,95 | 0,76±0,07 | 395,82±33,26 |
Группа 1 (органолептическое тестирование) | 3,39±1,02 | 573,57±172,48 | 0,47±0,06 | 159,54±28,23 |
Группа 2 (органолептическое тестирование) | 15,31±2,92 | 2048,59±265,63 | 0,77±0,06 | 383,8±31,76 |
Объединенный кластер | 12,01±2,08 | 1640,33±221,22 | 0,69±0,054 | 321,73±29,41 |
Достоверность различий между группами, р (кластерный анализ) | 0,009 | 0 | 0,02 | 0 |
Достоверность различий между группами, р (органолептическое тестирование) | 0,009 | 0,001 | 0,005 | 0 |
Пограничные образцы можно с уверенностью отнести к фальсифицированным по возрасту, так как многие образцы на границе можно отнести к качественным, если по своему наименованию они являются ординарными; в случае, если на этикетке нет указаний об их выдержанности (марочные), они относятся к фальсифицированным.
Из пограничных образцов 21f, 59au, 62au на этикетке образца 21f указано, что время выдержки в дубовой бочке составляет 3 года, у остальных — 10 лет и более; следовательно, образец 21f можно считать качественным, а другие два — нет.
Используя дополнительные характеристики образцов, удалось установить принадлежность к группам всех образцов; для 13 из 15 образцов при отнесении к группам кластерный анализ оказался более корректным, чем органолептический анализ.
Таким образом, кластерный анализ дает более точные результаты по сравнению с органолептическим тестированием, так как его проводили инструментальными методами только на основе физико-химических характеристик. Из 112 исследованных образцов ошибки при разделении с использованием кластерного анализа обнаружены всего в двух образцах.
Выводы.
Проведенный двухэтапный кластерный анализ позволил выделить физико-химические параметры, дающие возможность адекватно идентифицировать качество образца. В качестве маркеров подлинности коньячной продукции выделены этиловый эфир октановой кислоты, концентрация фенольных соединений, антиоксидантная емкость по отношению к катион-радикалу ABTS и интенсивность цвета. Определение дополнительных параметров (рН, антиоксидантная емкость по отношению к пероксильному радикалу, содержание сиреневого альдегида) требуется лишь в случае граничных результатов.
С использованием метода главных компонент визуализирован кластерный анализ и показана его корреляция с органолептическим тестированием.
Таким образом, выбранный набор маркеров может служить показателями качества коньячной продукции.
Список литературы
- ГОСТ р 51618-2000. Коньяки российские. Общие технические условия. — М.: изд-во стандартов, 2001. 11 с.
- Gerard, J. M. New Isotopic criteria for shortterm dating of brandies and spirits/J. M. Gerard, N. Lionel, N. Norbert, L. M. Maryvonne//J. Sci Food Agric. 1998. 77 (2). P 153-160.
- Lehtonen, P. J. Multi-method analysis of matured distilled alcoholic beverages for brand identification/P. J. Lehtonen, L. A. Keller, E. T. Ali- Matilla//Z Lebensm Unters Forsch. 1999. 208. P. 413-417.
- Picque, D. Discrimination of Cognacs and other distilled drinks by mid-infrared spectropscopy/D. Picque, P. Lieben, G. Corrien, R. Cantagre, O. Lablanquie, G. Snakkers//J Agric Food Chem. 2006. 54 (15). P. 5220-5226.
- Recuiel des methods internationals d'analyse des boissons spiritueuses des alcools et de la fraction aromatique des boissons Officiel International de la vigne et du vin O. I. V. (1994). Paris.
- Скурихин, И. М. Химия коньяка и бренди/И. М. Скурихин//М.: дели, 2005. 296 с.
- Pellegrini, N. Total antioxidant capacity of plant foods, beverages and oils consumed in Italy assessed by three different in vitro assays/N. Pellegrini, M. Serafini, B. Colombi, D. Rio, S. Salvatore, M. Bianchi & F. Brighenti// The Journal of nutrition. 2003. 133 (9). P. 28122819.
- Савчук, С. А. идентификация винодельческой продукции методами высокоэффективной хроматографии и спектрометрии/С. А. Савчук, В. Н. Власов//Виноделие и виноградарство. 2000. № 5. С. 5-13.
- Власов, В. Н. анализ качества бренди из винограда методом хромато-масс-спектрометрии/В. Н. Власов, Д. С. Маруженков//Виноград и вино. 1999. № 1. С. 28-31.
- Гулиев, Р. Р. определение содержания ароматических альдегидов в выдержанных коньячных спиртах методом газовой хроматографии/Р. Р. Гулиев, Т. А. Начева, С. В. Волкович, И. М. Скурихин//Виноделие и виноградарство. 2001. № 1. С. 17-18.
- Якуба, Ю. Ф. определение ароматических альдегидов в коньячных спиртах и коньяках/Ю. Ф. Якуба, Н. М. Агеева, Т. И. Гугучкина//Виноделие и виноградарство. 2005. № 3. С. 15.
- Panossian, A. Analysis of aromatic aldehydes in brandy and wine by high-performance capillary electrophoresis/A. Panossian, G. Mamikonyan, M. Torosyan, E. Gabrielyan, S. Mkhitaryan//J. Anal Chem. 2001. № 73. P. 4379-4383.
- Оселедцева, И. В. научно-практическая работа как поиск решения биотехнологических и экономических проблем при производстве натуральных вин и коньяков/и. В. Оселедцева, А. Н. Микелов, Э. М. Соболев, К. А. Бабаян — Материалы [1-й] науч.-практ. конф., 14 нояб. 2001 г. Ставроп. ин-т им. В. Д. Чурсина. изд-во Ставроп. ин-та им. В. д. Чурсина, 2001. С. 25-28.
- Gimenez, R. Determination of gallic acid in commercial brandies using hugh performance liquid chromatorgaphy/R. Gimenez, M. Villalon, M. Navarro, C. Cabrera, M. Olalla, J. J. Quesada, M. C. Lopez//Ciencia Tec. Aliment. 2000. № 3 (1). P. 13-20.
- Ou, B. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe/ B. Ou, M. Hampsch-Woodill & R. L. Prior//Journal of Agricultural and Food Chemistry, 2001. № 49 (10). P. 4619-4626.
- Huang, D. The chemistry behind antioxidant capacity assay/D. Huang, B. Ou, R. L. Prior//J. Agric. Food chem. 2005. № 53. P. 1841-1856.
- Re, R. Antioxidant activity applying an improved ABTS radical cation decolorization assay/R. Re, N. Pellegrini, A, Proteggente, A. Pannala, M. Yang, C. Rice-Evans//Free radical biology and medicine. 1999. № 26 (9/10) P. 1231-1237.
- Николаев, И. В. оценка антиоксидантной емкости коньяков/и. В. Николаев, О. В. Королева, Е. В. Степанова, Б. Ц. Зайчик//Виноделие и виноградарство. 2009. № 2. С. 13-15.
- Singleton, V. L. Colorimetry of total phenolics with phospohmolibdic-phosphotungstic acid reagents/V. L. Singleton, J. Rossi//Am. J. Enology and viticulture. 1965. № 16. P. 144-158.
- Зайчик, Б. Ц. Методы оценки подлинности коньяков. Сравнительные исследования их индивидуального состава/Б. Ц. Зайчик, А. О. Ружицкий, В. П. Хотченков, С. С. Щербаков, О. В. Королева//Виноделие и виноградарство. 2007. № 6. С. 12-13.
- Savchuk, A. M. Chromatographic Techniques in the Quality Control of Cognacs and Cognac Spirits/A. M. Savchuk, G. M. Kolesov//Journal of ananytical chemistry. 2005. № 60 (8). P. 752-771.
- Черняга, Б. С. Комплекс хроматографических методов контроля качества винодельческой продукции/Б. С. Черняга, И. Ш. Шатиришвили, Ш. И. Шатиришвили, К. И. Бериашвили//Технология переработки сельскохозяйственных продуктов. 2006. № 4 (1). С. 120-127.
- Гулиев, Р. Р. Международный метод определения цветности вин применительно к коньякам/Р. Р. Гулиев, Т. А. Начева, С. С. Дергачева, Л. В. Беркетова, И. М. Скурихин//Виноделие и виноградарство. 2002. № 3. С. 20-21.
- Валуйко, Г. Г. Теория и практика дегустации вин/Г. Г. Валуйко, Е. П. Шольц-Куликов//Симферополь: Таврида, 2005. 232 с.
- Pelligrini N. Total antioxidant capacity of plant foods, beverages and oils consumed in Italy assessed by three different in vitro assays/N. Pelligrini, M. Serafini, B. Colombi, D. Rio, S. Salvatore, M. Bianchi, F. Brighenti//The journal of nutrition. 2006. № 3. P. 2812-2818.
- Gomez-Cordoves, C. Application of principal component analysis to simple determinations of brandies as a means of verifying quality/C. Gomez-Cordoves, B. Bartolome//Z Lebensm Unters Forsch. 1993. № 197. P. 260-263.

