Техника выделения. Прежде чем приступить к исследованию какого-то штамма дрожжей и попытаться выделить его, необходимо получить из него абсолютно чистую культуру, выводя ее из одной клетки в самом строгом смысле слова. При этом поступают следующим образом. Пробирку, содержащую 10 см3 стерильного виноградного сусла, засевают минимальным количеством дрожжей, подлежащих изучению, беря из суспензии с помощью прокаленной платиновой петли. После перемешивания взбалтыванием эта пробирка служит для засева содержимого другой пробирки, которая в свою очередь используется для приготовления третьей. Содержимое этих трех пробирок выливают в три стерильные чашки Петри и смешивают с таким же -объемом 20%-ного желатина, расплавленного легким нагреванием. Оставляют остыть и затвердеть на ровной поверхности.
Основные виды аспорогенных дрожжей, выделенных из сусел и вин [измененные названия, употребляемые в монографиях Лоддер и Крегер-Ван Рижа (1952—1967) и Лоддер (1970), и названия новых видов]
Ролы | Названия дрожжей | |||
прежние | новые | неизмененные | новые виды | |
Brettanomyces | Br. schanderlii Br. vini | Br. intermedius | Br. bruxellensis | — |
Candida | C. mycodenma C. vanrijii | C. vini C. sake | C. guilliermondii C. krusei C. melinii C. parapsilopsis C. pelliculosa C. solani C. utilis C. zeylanoides |
|
Cr.yptococcus |
|
| Cr. albidus Cr. laurentii | — |
Kloeckera | KL jensenii Kl. magna | Kl. javanica KL corticis | Kl. africana l — Kl. apiculata | |
Metschnikowia | C. ptuldserrima M. pulcherrima |
|
| |
iRhodotorula
Rh. gtutinis Rh. mucilaginosa Т. colliculosa Т. dattila
Т. cantarellii Т. domercqii
| Т. famata | Т. | Candida |
|
Torulopsis | Т. bacillaris Т. stelllata | Т. | stellata | Т. holmii Т. glabrata Т. inconspicua |
После нескольких дней пребывания чашек Петри в покое при температуре 20° С на поверхности плотной питательной среды или в глубине появляются колонии. С помощью ушка иглы из платины или нержавеющей стали, прокаленных в пламени спиртовки, отбирают некоторое число колоний (одну за другой), выросших каждая из одной клетки. В гетерогенной культуре они могут принадлежать к различным видам. Каждую вводят в пробирку со стерильным суслом. Проводят второй рассев на чашки Петри и выделение культур, прежде чем применить тесты классификации.
Основные виды спорогеиных дрожжей, выделенных из сусел вин [измененные названия, употребляемые в монографии Лоддер (1970), и названия новых видов]
| Название дрожжей | |||
Рода | прежние | новые | неизмененные | новые виды |
Endomycopsis | E. lindneri | E. vini |
|
|
Hanseniaspora |
|
| Hspora valb ensis | H'spora osmophila |
Hansenula |
|
| H. anomala H. subpelliculosa |
|
Kluyveromyces | Sacch. veronae | K. veronae |
|
|
Pichia |
|
| P. fermentans P. membranaefaciens | P. vini |
| Sacch. acidifciens . Sacch. elegans Sacch. bayanus Sacch. oviformis Sacch, pastorianus | Sacch. bailii Sacch. bayanus | Sacch. bisporus Sacch. delbrueckii | Sacch. aceti |
Saccharomyces | Sacch. cerevisiae Var. ellipsoideus | Sacch. cerevisiae | Sacch. exiguus Sacch. fermen tati | Sacch. globosus |
Продолжение
| Названия дрожжей | |||
Роды | прежние | новые | неизмененные | новые виды |
| Sacch. carlsbergensis | Sacch. uvarum |
| Sacch. transvaalensis |
Saccharomycodes |
|
| S'codes ludwigii |
|
Schizosaccharomyces |
|
| Schiz. pombe | Schiz. malide- |
Питательная среда. Наиболее подходящей средой для размножения винных дрожжей является виноградный сок. Сусло, полученное в период сбора урожая и консервированное посредством пастеризации, фильтруют, затем разливают по 10 см3 в пробирку, закрывают ватной пробкой. Наполненные пробирки нагревают до 100° С.
Можно также использовать пивное сусло, обработанное таким же образом, или искусственные среды следующего состава:
дрожжевой отвар из 200 г хлебопекарных дрожжей на 1 л, более или менее разбавленный, или дрожжевой экстракт из сушеных дрожжей из расчета 5 г/л;
синтетическая среда, содержащая в 1 л 100 г сахарозы; 6 г лимонной кислоты; 5 г дрожжевой золы (или смеси неорганических веществ); 2 г кислого фосфорнокислого калия; 2 г аспарагина, 1 г сульфата аммония.
Среду доводят до нужного рН едким кали, добавляют следующие витамины: тиамин, пиридоксин, никотинамид, пантотеновую кислоту, Р-аминобензойную кислоту (от 0,2 до 1 мг), биотин (от 20 до 100 мкг), мезоинозит (от 5 до 10 мг).
Для сохранения штаммов используют солодовый агар, приготовленный на натуральном солодовом сусле, разбавленном до 15% СВ 1,059) и нейтрализованном до рН 7; в нем растворяют в горячем состоянии агар из расчета 15 г/л, распределяют по пробиркам, стерилизуют 15 мин при 120° С и оставляют остывать в пробирках в наклонном положении.
Следующая среда, на которой Saccharorayces хорошо спорулируют и долго сохраняются, приготовляется таким путем: настаивают 125 г тертой моркови в 1 л воды в течение 1 ч; настой доводят до кипения и через 10 мин кипячения фильтруют через вату, доводят до рН 5 и растворяют 30 г агара на 1 л.
Культуры дрожжей хранят на жидкой или плотной среде при низких температурах. Их пересевают каждые 4—6 мес и после нескольких дней развития вновь помещают на холод. Пересев производят из жидкой среды на плотную или наоборот. Пробирки с культурами закрывают колпачками во избежание проникновения плесеней и уменьшения испарения.
Форма и размеры клеток дрожжей. В микроскоп (увеличение 900 раз) можно видеть молодые клетки в состоянии полной активности и почкования через 3 или 4 дня культивирозания в жидкой среде при 25° С Можно также рассмотреть более старые культуры; при этом некоторые формы становятся более выраженными. Уже такое изучение позволяет различать некоторые роды по величине и форме клеток: Kloeckera и Hanseniaspora (маленькие заостренные), Saccharomycodes (большие заостренные), Тоrulopsis stellata (очень маленькие эллиптические). Размеры клеток определяют с помощью микрометра, отмечают также характер почкования. В действительности дрожжевая популяция в чистой культуре состоит из клеток всех размеров и часто различной формы. Иногда трудно определить средние размеры и форму. К тому же и описание оказывается недостаточным ввиду неточности эпитетов: овальная, эллиптическая, удлиненная; ее требуется дополнять рисунком или фотографией.

Рис. 5.5 Гигантские колонии некоторых штаммов Saccharomyces: а. б, г — Sacch. ellipsoidcus; в — Sacch. rosei.
Образование спор. Эта характеристика имеет фундаментальное значение, так как она позволяет относить изучаемые дрожжи к спорогенным видам семейства Saccharomyeetacees или же к аспорогенным — Cryptococcacees. Но это иногда трудно выявить, так как обычно во время длительного хранения некоторые виды теряют способность к спорулированию. Чтобы наблюдать споруляцию, культуру выращивают на поверхности в среде с агаром: солодовом сусле, морковном отваре или на среде Городковой (на 1л): 1 г глюкозы, 10 г пептона, 5 г хлористого натрия. Дрожжи заостренной формы (апикулятус) хорошо спорулируют на солодовом сусле-агаре. Наблюдения с помощью микроскопа проводят по нескольку раз в месяц.
Характеристики культуры. Нельзя разработать классификацию на основании только этих характеристик, но они дают возможность подтверждать другие тесты дифференциации. Отмечают: 1) вид колонии на сусле с желатинам, ее способность разжижать желатину (протеолиз); 2) вид культуры на виноградном сусле: появление осадка, флоккуляция, образование поверхностного кольца, пленки, устойчивой пены; 3) вид культуры на сусле-агаре: цвет, поверхность (блестящая или матовая, гладкая или морщинистая), особая форма; 4) характерные признаки гигантской колонии на виноградном сусле с желатиной.
Для того чтобы получить гигантскую колонию, опускают одну каплю дрожжевой разводки в центр чашки Петри, затем чашку оставляют при температуре 20° С и наблюдают по истечении 1 или 2 мес. При этом отмечают цвет, форму развития (концентрическую или лучевую), вид поверхности (матовую или блестящую, сухую или влажную), рельеф, толщину. Некоторые дрожжи можно опознать по их гигантским колониям, другие же не образуют характерных колоний. Кроме того, штаммы одного и того же вида могут образовать гигантские колонии различной формы и в то же время разные виды могут представлять собой одинаковые гигантские колонии. Внешний вид гигантской колонии зависит от скорости размножения, формы клеток и особенностей их почкования, от угла, под которым образуются древовидные ответвления дочерних клеток на материнских, а также от состава и консистенции плотной среды. Тест не всегда можно воспроизвести. На рис. 5.5 показаны некоторые гигантские колонии.
Рис. 5.6. Трубки для брожения: а — Дурхэма; б — Эйнгорна.
Сбраживание различных сахаров. Способность сбраживать различные сахара (см. гл. 15, раздел «Брожение сахаров дрожжами») зависит от присутствия в клетке различных специфических ферментов. Следовательно, это одна из стабильных характеристик дрожжей, которая может служить основой для классификации. Ключ для определения видов, например, в роде Saccharomyces, основан на этом признаке.
Для сбраживания сахаров характерно выделение углекислого газа, наблюдаемого в трубке Дурхэма или в трубке Эйнгорна (рис. 5.6). Считают, что первый прибор более чувствителен, чем второй. Для опытов используют глюкозу, галактозу, сахарозу, мальтозу, лактозу, рафинозу. Дрожжи, которые сбраживают глюкозу, сбраживают также фруктозу и маннозу и нет необходимости испытывать эти два сахара. Основная питательная среда содержит 5 г дрожжевого экстракта на 1 л. Каждую трубку с одним из сахаров (5 г на 1 л) засевают двумя каплями исследуемых дрожжей; помещают в термостат с температурой 25° С. Десять дней подряд проверяют появление пузырьков углекислого газа.
Инвертаза или сахараза, которая превращает сахарозу в глюкозу и фруктозу, дает возможность дрожжам, обладающим этим ферментом, сбраживать сахарозу. В действительности сахарозу могут сбраживать два. разных фермента — фруктозидаза, расщепляющая фруктозу, и глюкозидаза, разлагающая глюкозу. Рафиназа, которая отделяет фруктозу от молекулы, рафинозы, также является фруктозидазой. Рафиноза представляет собой трисахарид, образованный из моносахарида фруктозы и из дисахарида мелибиозы, которая в свою очередь состоит из глюкозы и галактозы. Мальтаза, расщеляющая мальтозу на две молекулы глюкозы, также является глюкозидазой. Большая часть дрожжей, которые сбраживают сахарозу, сбраживают также и рафинозу, но могут не действовать на мальтозу (например, в случае Sacch. chevalieri).
Санта Мария (1964) исследовала использование сахарозы и мальтозы дрожжами. Мелибиаза или, а-галактозидаза, гидролизует мелибиозу рафинозы в глюкозу и галактозу. Следовательно, в зависимости от вида дрожжей рафиноза может быть сброжена на 1/3 (дрожжами, имеющими фруктозидазу, но не имеющими а-галактозидазу), на 2/з (дрожжами, имеющими фруктозидазу и а-галактозидазу, но не сбраживающими галактозу) или полностью (дрожжами, обладающими, кроме того, способностью сбраживать галактозу).
Поскольку рафиноза не относится к восстанавливающим сахарам, а сахара после ее гидролиза являются таковыми, нетрудно определить титрованием раствора Фелинга через 3—4 нед брожения, какое влияние исследуемые дрожжи оказали на рафинозу. Методом хроматографии на бумаге можно также выявить сахара, оставшиеся после сбраживания рафинозы. Лактаза, или бета-галактозидаза, мало распространенная в дрожжах, разделяет лактозу на глюкозу и галактозу.
Более полный тест включает также испытания целлобиозы, трегалозы, инулина, крахмала и др.
Ассимиляция различных сахаров. Все сахара, сбраживаемые дрожжами, усваиваются также в аэробной культуре, но не все ассимилируемые сахара сбраживаются, следовательно, тест ассимиляции применим только к несброженным сахарам. Основной средой является синтетическая среда, описанная выше в разделе «Питательная среда».
Засевают каждую трубку, содержащую 5 г субстрата на 1 л двумя каплями дрожжевой разводки (культура трехдневная), параллельно приготовляют одну контрольную трубку с глюкозой, другую — без какого-либо сахара; эти трубки показывают интенсивность развития. Результаты регистрируют в течение 15—30 дней при температуре 25° С; приводят дрожжевой осадок во взвешенное состояние и сравнивают степень помутнения. Можно использовать абсорбцио-метр, позволяющий вычислить интенсивность развития. Тем не менее интерпретация полученных результатов не всегда бывает легкой, иногда более интенсивное развитие отмечается в среде без сахара, особенно для пленчатых дрожжей.
Полные тесты ассимиляции включают помимо тех, которые используются в тестах брожения, следующие вещества: сорбозу, ксилозу, арабинозу, рибозу, рамнозу, этанол, глицерин, эритрит, рибит, галактит, маннит, инозит, сорбит, салицин, кислоты: молочную, лимонную, янтарную и др. Такие тесты требуют значительных объемов питательной среды и соответствующего оборудования. Шарпантье и Бержере (1972) описали оборудование и стандартные способы исследования процессов сбраживания и аэробной ассимиляции 39 углеводных соединений. К качественным характеристикам прибавляют количественную информацию, отмечая скорость появления характеристик, что дает возможность определить штаммы (расы) в пределах вида. Разрабатывают карточки, показывающие «профили» штаммов.
Такие карточки обрабатываются на ЭВМ в числовой классификации.
Избирательное сбраживание глюкозы и фруктозы. Известно, что в присутствии смеси глюкозы и фруктозы, такой, как инвертный сахар, дрожжи воздействуют прежде всего на глюкозу и после этого поглощают фруктозу.
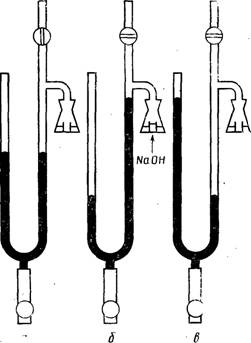
Рис. 5.7. Схема манометрического аппарата Варбурга для измерения интенсивности дыхания и брожения:
а — исходное положение манометра; б — измерение интенсивности дыхания; в — измерение интенсивности брожения.
По этой причине сахар, который остается в белых ликерных винах, представляет собой главным образом фруктозу. Но некоторые дрожжи ведут себя по-другому. При расчете процентного содержания сброженной глюкозы, когда 50% фруктозы уже исчезло, различают три категории дрожжей:
дрожжи, сбраживающие к этому моменту от 80 до 85% глюкозы. Это наиболее многочисленные, глюкозо- фильные дрожжи. К этой категории относится большая часть видов Saccharomyces, а также Saccharomycodes и Brettanomyces;
дрожжи, которые предпочтительно поглощают фруктозу или фрутозофильные; они используют в этих условиях только от 5 до 10% глюкозы. Их представляют три вида: Sacch. bailii, Sacch. rouxii и Т. stellata;
- дрожжи, разлагающие оба сахара с почти одинаковой скоростью, во всяком случае, с начала брожения. К моменту, когда они поглощают половину фруктозы, исчезает от 40 до 60%) глюкозы. В эту категорию входят восемь видов дрожжей, в том числе виды Hanseniaspora.
Интенсивности дыхания и брожения. Уровни интенсивности дыхания (Qo, и сбраживания (Qу молодых клеток, культивируемых на одной и той же синтетической среде, содержащей глюкозу, полной с точки зрения содержания минеральных и азотсодержащих веществ, а также витаминов и исследуемых на одной стадии развития, измеряют с помощью манометрического прибора Варбурга (рис. 5.7). Процентное содержание дыхательного фермента клетки изменяется в зависимости от степени аэрации питательной среды. В противоположность этому интенсивность сбраживания является относительно постоянной в течение всего периода брожения и снижается только к его концу, когда число живых клеток уменьшается. Интенсивность сбраживания выражают в мм3 газа на 1 мг сухих дрожжей в час.
Лафон разделил дрожжи по этому признаку на шесть групп:
- дрожжи только окисляющие. Debaryomyces, выделенные из вин, и С. vini не вызывают сбраживания сахаров или сбраживают их только в виде следов. Интенсивность дыхания равна примерно 25;
- P. fermentans и Н. anomala имеют интенсивность дыхания, часто равную и иногда превосходящую интенсивность сбраживания;
- М. pulcherrima имеет достаточную окислительную способность и малоактивна с точки зрения сбраживания. Отношение дыхания к брожению равно 30 : 90;
- для Sacch. bailii дыхание составляет от 13 до 18%. В эту же категорию входят виды Hanseniaspora. Интенсивность сбраживания составляет лт 100 до 150 при интенсивности дыхания от 15 до 20;
- у рода Saccharomyces отношение дыхания к брожению всгда ниже 10% при интенсивности брожения от 200 до 300. Такие же данные и у Тоrulopsis stellata при несколько более слабой интенсивности брожения;
- Brettanomyces — дрожжи с замедленным метаболизмом, имеют слабую интенсивность дыхания при интенсивности сбраживания около 50.
Кривые брожения — спиртообразующая способность. Последняя определяется по максимальной спиртуозности, полученной при использовании исследуемых дрожжей в сусле с достаточным содержанием сахара. Опыты проводили в небольших склянках для брожения вместимостью 90 см3, содержащих 60 см3 сусла. В одной серии склянок ведут анаэробное брожение под стеклянной трубкой с оттянутым тонким концом, в другой — они закрыты простыми ватными пробками. Склянки оставляют на брожение в термостате при 25°С. Повторные взвешивания позволяют начертить кривые потерь массы. В конце брожения определение спиртуозности или количественный анализ остаточного сахара показывает спиртообразующую способность данного вида дрожжей.
Побочные продукты сбраживания сахара. Известно, что при брожении наряду со спиртом и углекислым газом по схеме глицерино-пировиноградного брожения Нейберга образуется ряд шобочных и вторичных продуктов. Эквивалентность между глицерином (г) и суммой других вторичных продуктов: уксусной кислоты (у), янтарной кислоты (я), 2,3-бутандиола (б), ацетоина (а), остаточного свободного ацетальдегида (э) — с коэффициентом при каждом из них, выведенным из химического уравнения, установлена аналитически. Было предложено следующее уравнение, вытекающее из баланса спиртового брожения Нейберга:
Анализы многих сотен брожений, проведенных в различных условиях, доказали, что Е изменяется от 0,8 до 1,0 г. Это уравнение эквивалентности подтверждается для всех дрожжей родов Saccharomyces и Saccharomycodes. Эти дрожжи имеют только бродильный метаболизм.
Для другой группы дрожжей, включающих роды Torulopsis и Hansermla, это отношение действительно только в условиях абсолютного анаэробиоза и непригодно даже при очень слабой аэрации; эти дрожжи образуют много уксусной и янтарной кислот, часть которых образуется в процессе дыхания.
Для дрожжей рода Hanseniaspora предыдущее равенство справедливо только при слабой аэрации и не подходит для среды с большим доступом воздуха.
Отношение глицерина к спирту в конце брожения при прочих равных условиях мало изменяется в зависимости от дрожжей и не позволяет различать их виды. Но они дифференцируются пропорциями различных побочных продуктов брожения. Существуют также дрожжи, образующие уксусную кислоту, янтарную и глицерин. Знание этих характеристик, в частности образование летучих кислот, имеет непосредственный интерес к энологии.
Следует также указать на образование этилацетата, сложного эфира, известного как вещество, придающее испорченным винам признаки скисания. Все винные дрожжи вырабатывают этилацетат в различном процентном содержании. Тогда как виды Saccharomyces и Torulopsis являются наименее эстерогенньши (дают наименьшие количества сложных эфиров), Hanseniaspora uvarum, Saccharomycodes ludwigii и особенно виды Pichia и Hansenula, образующие на поверхности пленки, дают повышенное процентное содержание этилацетата, способного придавать винам признаки испорченных вин.
Образование высших спиртов, частично связанное с питанием дрожжей азотом и изменяющееся в зависимости от видов, может также дать дополнительные данные, полезные для классификации.
Ассимиляция нитратов.
Свойство использовать нитраты, т. е. превращать их в усвояемый азот, является важным критерием в таксономии дрожжей в силу его надежности. Большинство дрожжей не усваивают нитраты; с другой стороны, род Hansenula характеризуется своей способностью использовать их и тем отличается от рода Pichia. Некоторые дрожжи рода Brettanomyces также усваивают нитраты.
Ассимиляция гидрата окиси аммония, введенного в виде сульфата аммония, может также способствовать дифференциации видов Kloeckera,
Hanseniaspora, которые не могут его использовать, и видов Torulopsis, плохо усваивающие его. Другие дрожжи в качестве азотного питания лучше усваивают гидрат окиси аммония.
Жидкая среда, использованная для изучения этого признака, имела следующий состав (в г на 1 л): глюкоза — 10, кислый фосфорнокислый калий — 1; сернокислый магний — 0,5; хлористый кальций — 0,1; хлористый натрий— 0,1. Факторы роста добавляют в той же дозе, как и для усвоения сахаров (или 1 г нитрата калия, или 1 г сернокислого аммония).
Использование этанола.
Такой анализ имеет лишь второстепенное значение для идентификации дрожжей, так как этим свойством обладают только редкие виды. Используемая среда идентична описанной выше, без глюкозы, но с сульфатом аммония. Перед посевом добавляют 3% этилового спирта. Контроль развития проводят через 2 нед путем сравнения со склянкой без спирта.
Потребности в факторах роста. Потребность дрожжей в факторах роста (биотин, лиридоксин, тиамин, пантотеновая кислота, мезоинозит, никотинамид, парааминобензойная кислота) характерна для всех видов, встречающихся в винах. Определения ведут на простой среде, описанной выше в разделе «Питательные среды», содержащей только перекристаллизованные вещества. Для каждой культуры дрожжей (готовят восемь пробирок; одна пробирка не получает ни одного фактора роста, другая получает их все, остальные шесть пробирок получают (Все факторы роста, за исключением одного, каждый раз разного. Таким образом, изучают индивидуально все случаи недостаточности. При обсеменении реализуют постоянную исходную популяцию из одной или двух дрожжевых клеток на 1 мм3.
Поведение дрожжей контролируют в три этапа:
- в первые часы оценивают рост нефелометрическим изменением, проводимым непосредственно на пробирках после взбалтывания;
- за ходом брожения следят путем взвешивания пробирок, закупоренных трубкой с оттянутым концом через одинаковые промежутки времени, например через каждые 2 дня;
- переходят к подсчету дрожжей с помощью счетчика клеток.
В результате получают данные одновременно как по скорости роста, так и по скорости и пределу сбраживания сахара.
Таким образом, различают прототрофные дрожжи, которые могут развиваться и вызывать брожение в среде, совершенно лишенной факторов роста, так как они способны их синтезировать, и дрожжи ауксотрофные, К1оeckera, Saccharomycodes, Hanseniaspora, неспособные размножаться, если в питательном растворе не хватает какого-нибудь витамина. Для прототрофных видов, для которых факторы роста не являются обязательными, они тем не менее играют роль активаторов в процессах размножения и брожения.
Эти характеристики довольно специфичны, чтобы быть использованными при идентификации дрожжей.
Влияние температуры.
Наблюдая за ходом брожения виноградного сусла путем взвешивания склянок при различных температурах, например 4, 13, 20, 25, 30 и 35° С, и вычерчивая кривые потерь углекислого газа, можно сравнивать поведение различных видов дрожжей.
По этим данным винные дрожжи разделяют на пять групп:
1) Виды Saccharomyces, представляющие собой прекрасную иллюстрацию к закону: «начало брожения проходит тем быстрее и получаемая спиртуозность тем ниже, чем выше температура» (ом. гл. 7, раздел «Влияние температуры на скорость и предел брожения виноградного сусла»). Для этих довольно холодоустойчивых дрожжей максимум сброженного сахара достигается при 13° С; при 4° С сбраживается от 55 до 75% этого максимума; при 30 и 35° С трансформируется только половина;
- более термофильные дрожжи, включающие Sacch. bailii, Sacch. heterogenicus, Т. stellata и Saccharomycodes ludwigii. Эти дрожжи имеют оптимум брожения при 25° С и еще более активны при 30—35° С, с другой стороны, они плохо сбраживают сахара при 4 и 13° С. Отсюда можно было бы заключить о целесообразности использования этих дрожжей в районах жаркого климата; к сожалению, это плохие дрожжи с точки зрения виноделия (слабая способность спиртообразования, образование значительных количеств уксусной кислоты и этилацетата);
- виды Hanseniaspora и Kloeckera, к которым можно присоединить Sacch. rosei. Эти дрожжи классифицируются между группами 1 и 2. Здесь оптимальная температура равна 20° С.
- виды Brettanomyces, сбраживающие преимущественно при высоких температурах. Лаг-фаза у этих дрожжей довольно продолжительная при 25°С (от 8 до 10 дней), очень короткая при 30—35°С (2—3 дня);
- дрожжи, мало подверженные действию температуры, ведут себя почти одинаково при всех температурах— от 13 до 35°С. К ним относятся М. pulcherriima, Sacch. rouxii.
Устойчивость к сернистому ангидриду. Знание устойчивости дрожжей к сернистому ангидриду, внесенному в сок или в бродящую среду, чтобы задержать забраживание, и к дозам SO2, применяемым для консервирования вин с остаточным сахаром (недобродов), имеет непосредственное значение для практики виноделия. Опыты по сбраживанию виноградного сусла при введении доз сернистого ангидрида от 100 до 400 мг/л, засеянного сразу же после такого добавления постоянным числом дрожжей, позволяет разделить дрожжи на три группы:
1) чувствительные к этому антисептику и не развивающиеся при сульфитации сусла дозами от 100 до -150 мг/л; это Sacch. rosei, Kloeckera и Hanseniaspora;
2) устойчивые к дозам от 100 до 150 мг/л, но не более; к ним относятся Sacch. ellipsoideus, Т, stellata, один штамм Sacch. oviformis;
3) высокоустойчивые, способные выдержать очень высокие дозы. Штаммы разновидности oviformis вызывают брожение при 250 мг/л сернистой кислоты. С дрожжами Sacch. bailii брожение может начаться при дозах от 250 до 400 мг/л; Saccharomycodes ludwigii прекрасно выдерживают 400 мг/л.
Устойчивость к актидиону. Ингибирующее действие актидиона было определено для многих видов дрожжей, в частности для тех, которые играют определенную роль (В приготовлении и хранении вин( см. гл. 9, раздел «Противогрибные антибиотики»). Ниже приведен спектр лротиводрожжевого действия актидиона; он показывает концентрации (в мг/л), оказывающие ингибирующее воздействие в течение месяца на брожение виноградного сока, обсемененного дрожжами из расчета 10 000 клеток на 1 см3 (Пейно и сотрудники, 1962).
Sacch. bailii 5
Sacch. ellipsoideus 10
Sacch. ovifomis, chevalieri, roseif, fer- 20
mentati
Saccharomycodes ludwigii, Hansenula 20
anomala
Sacch. heterogenicus 30
Sacch. delbrueckii 100
T. Stellata, Br. vini, Br. schanderlii 100 Hanseniaspora uvarum, Kloeckera apiculata !
Этот тест может помочь идентификации устойчивых дрожжей. Однако выявлены некоторые штаммы Sacch. oviformis и Sacch. bailii, безразличные к актидиону.
Исследование антигенов. Классификация дрожжей с помощью серологических тестов была испытана многими авторами. Используя моноспецифические сыворотки и два серологических способа, Шарпантье и сотрудники (1971) доказали существование антигенного родства между семью видами винодельческих дрожжей; эти черты сходства, вероятно, могли бы объяснить, по мнению этих авторов, постоянство порядка появления видов дрожжей во время приготовления вина.

