При прочих равных условиях активность дрожжей зависит от их насыщенности азотом. Уместно привести такой пример. Одну из рас Sacch. ellipsoideus культивируют в средах, содержащих большее или меньшее количество азотистых веществ, чтобы таким образом получить дрожжи, более или менее обогащенные азотом. Интенсивности дыхания и брожения этих дрожжей измеряют аппаратом Варбурга. Результаты приведены в табл. 7.11.
таблица 7.11
Содержание азота и метаболизм
Азот в дрожжах, мг на 100 мг сухих : дрожжей | Q , мм' на 1 г | со |
4,1 | 33 | 189 |
5,1 | 33 | 193 |
5,8 | 37 | 205 |
7,5 | 22 | 258 |
8,5 | 18 | 298 |
8,9 | 15 | 301 |
Из табл. 7.11 видно, что чем богаче дрожжи азотом, тем выше интенсивность брожения и тем слабее интенсивность дыхания. Когда содержание азота в дрожжах удваивается, дыхание уменьшается наполовину, ферментативная же способность возрастает на 50%. Отсюда понятна заинтересованность в том, чтобы иметь в своем распоряжении среду, хорошо обеспеченную азотистыми веществами для получения быстрого брожения.
Эффект обогащения сусла аммиачным азотом
Обычно аммиачное сусло содержит достаточное количество аммиачного азота. И все же в некоторые годы хорошей зрелости винограда можно наблюдать недостаточность аммиачного азота в винограде; то же самое происходит с суслом из винограда, пораженного гнилью, когда Botrytis cinerea поглощает эту форму азота. Недостаток этого элемента может затруднить брожение сусла. Для того чтобы иметь лучшее брожение, правила предусматривают возможность добавления в виноград аммиачной соли перед дроблением. В качестве стимулятора размножения дрожжей в виноделии также разрешается применять фосфат аммония, в котором фосфорная кислота играет второстепенную роль и практически активирование брожения является результатом действия только введенного в сусло аммиачного азота.
Из рис. 7.12. видно, что 200 мг/л фосфорного аниона несколько облегчают забраживание, но после 12 дней популяция дрожжей и концентрация остаточного сахара совершенно идентичны с этими же показателями в контрольном сусле.
50 мг/л аммиачного азота в виде хлорида, сульфата или фосфата вызывают довольно заметное ускорение брожения и при дозе 100 мг/л масса сахара, сбраживаемого в течение 24 ч, удваивается. Общее число дрожжевых клеток за это же время возрастает на 25%. При дозе аммиачного азота, равной 200 мг/л, результаты такие же.

Рис. 7.12. Влияние добавления аниона фосфора и катиона аммония в сусло (в мг/л):
а —на ход брожения; б— на рост дрожжей; 1 — контроль; 2— 200 РО4; 3 — 20 NH4; 4 — S0NH4; 5—IOONH4; 6 — 200 NH4.
При равных дозах аммиачного азота активация, вызываемая фосфатом аммония, имеет интенсивность того же порядка, как и вызываемая другой солью.
Если исследовать поведение дрожжей в случае брожения, когда они развиваются после введения аммиачного азота, сравнивая число живых клеток и общую популяцию с контролем, то приходится констатировать, что действие аммиака, введенного в сусло, продолжается до конца брожения. Число живых клеток несколько повышается по сравнению с контролем, и задержка во времени, в течение которого они продолжают размножаться, растягивается до двух дней, что позволяет им сбраживать больше сахара.
Момент добавления До брожения | Через 2 дня | Через 4 дня | Через 8 дней |
Количество остаточного аммиачного 1 | 34 | 47 | 66 |
азота в конце брожения, мг/л |
|
|
|
Фиксированию аммиачного азота дрожжами явно способствует наличие кислорода. Данные количественного анализа аммиачного азота, проводившегося до и после брожения, показывают, что дрожжи могли использовать 200 мг/л азота, когда они развивались 'без воздуха, и до 300 мг/л — в присутствии воздуха.
Поскольку размножение клеток особенно интенсивно протекает в первые часы брожения, то ясно, что аммиачные соли следует добавлять в точно рассчитанный момент. В серию бутылей с виноградным суслом, обсемененным одной и той же расой дрожжей, добавляли азот из расчета 100 мг/л в виде солей аммиака в различные моменты брожения. По окончании брожения определяли количество аммиачного азота, оставшегося в вине, т. е. того, который не был использован. Полученные данные приведены ниже.
Следовательно, дрожжи лучше усваивают аммиачный азот, когда его вводят в сусло до начала брожения. Через 2 дня они усваивают только 2/3, через 4 дня лишь половину и через 8 дней всего 1/3 добавленного азота. Поэтому аммиачный азот следует вносить до начала брожения. В отдельных случаях, когда к концу брожения дрожжи становятся недеятельными, рекомендуется добавлять соли аммиака, чтобы их активировать. В этих условиях они используют этот азот не полностью.
Необходимо также отметить, что добавление аммиачных солей в сусло производит подкисляющее действие, так как дрожжи фиксируют катион и высвобождают анион. Так, прибавление 10 г азота на 100 л повышает общую кислотность на 0,35 г/л (в переводе на серную кислоту).
Фланзи и сотрудники (1964), Фланзи и Пу (1965) подтвердили, что дрожжи способны фиксировать большие количества катиона аммония, добавляемые к суслу. Дрожжи образуют аминокислоты, и поэтому можно обогащать вина аминокислотами в довольно значительном количестве и увеличить в 3 или 4 раза содержание общего азота. По мнению этих авторов, к аминокислотам, содержание которых увеличивается в наибольшей степени, относятся гистидин, лизин, ароматические аминокислоты, аспарагиновая кислота, аланин. Содержание глутаминовых кислот, по-видимому, увеличивается в вине меньше по сравнению с другими, однако Риберо-Гайон и Пейно (1966) наблюдали обратное.
Ассимиляция аминокислот
Рост дрожжей Saccharomyces стимулируется присутствием в среде некоторых аминокислот. Хотя эти дрожжи способны синтезировать из аммиачного азота все необходимые аминокислоты, их размножение явно улучшается, когда добавляют каждую аминокислоту отдельно, и еще в большей степени, когда .вводят смесь аминокислот. Используемые в качестве единственного источника,: азота, они обычно. имеют меньшую питательную ценность по сравнению с аммиачным азотом, за исключением лишь аспарагиновой и глутаминовой кислот и их амидов.
Допускают, что аминокислоты усваиваются дрожжами на основе трех различных механизмов:
- Реакция Эрлиха, которая в результате дезаминирования и декарбоксилирования является источником образования высших спиртов, тирозола, триптофана, янтарной кислоты и др.
- Реакция окисления-восстановления Стрикленда; она объясняет почему смесь аминокислот более эффективна как элемент питания, чем тот или иной из ее компонентов, взятый в отдельности. Существуют аминокислоты-доноры (1) и аминокислоты-акцепторы (2) водорода:
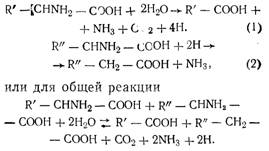
Согласно этим реакциям аминокислоты являются питательными веществами за счет аммиака, который они высвобождают.
3. Торн указал на существование прямого усвоения аминокислот среды. Дезаминирование путем других механизмов может быть необходимо, когда смесь присутствующих аминокислот не в точности соответствует дрожжам.
Ассимиляция аминокислот и их биосинтез — два процесса азотного питания — стали предметом многочисленных работ последнего времени, и в настоящее время известно много ферментативных реакций, протекающих при этих явлениях. Они заинтересовали биохимиков, специалистов пивоваренного производства (Хэлворсон и Коэн, 1958; Джоунс и сотрудники, 1964; Мочет и Ахмад, 1965; Брэди, 1965; Абади, 1967; Палмквист и Эйрепее, 1969, 1970).
Классификация аминокислот в зависимости от их усвояемости (2,3), питательной ценности (4), процентного содержания в дрожжах (5), роли в явлениях выделения (6) и эксорбции (7)
|
| Ассимиляция, % |
|
|
|
| Аминокислоты, выделенные дрожжами | |||
Аминокислоты
|
индивидуальная
|
смеси | Выход дрожжей. | Состав дрожжей, | ||||||
| г/л |
| % | живыми | мертвыми | |||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | ||||
Лейцин | Leu. |
| Arg. | От 70 | Leu. 1 |
| Glu. |
| Glu | Glu |
Изолейцнн | iLeu. |
| Try. | Met. |
| Lys. 1 | Свыше 10 | Pro | Pro | |
Метионин | Met. | От 90 | iLeu. | Ser. |
| Val. 1 |
| Met | Lys | |
Цистеин | Cys. | Cys. . |
| Glu. | От 1,0 | Thr. 1 |
| Arg | Ser | |
Глутаминовая | Glu. i | Met. |
| Val. | до 2,0 | Ser. 1 |
| Cys | Asp | |
кислота |
|
|
|
|
|
|
|
|
|
|
Триптофан | Try. |
| His. | От 50 до 70 | Try. |
| iLeu. | От 5 | Gly | Leu |
Гликокол | Gly. |
| Val. | Pro.' |
| Leu. | до 10 | Ser | Val | |
Аспарагин | Asp. | От 50 | Asp. | Tyr. |
| Asp. | Val | iLeu | ||
Феиилаланин | Phe. | Thr. |
| iLeu. | От 0,5 | Gly. |
| Thr | Ala | |
Валнн | Val. | Tyr. |
| Phe. | до 1,0 | Pro. | His | Phe | ||
Треонин | Thr. |
| Phe. |
| Asp. |
| Ala. |
|
| Thr |
Тирозин | Туг. |
| Ser. |
| Gly. |
| Arg. |
|
| Gly |
Аргинин | Arg. |
| Lus. |
| His. |
| Phe. |
|
| Tyr |
Серии | Ser. | От 16 | ciy | 'Менее 50 | Thr. | 0,5 | Tyr. | Менее 5 |
| Cys |
Пролин | Pro. | до 50 | Glu. |
| Arg. | Met. |
| His | ||
Гистнднн | His. | 0 | Leu. | 0 | Cys. |
| His. |
|
| Arg |
Лизин | Lus. | Pro. | Lys. | 0 | Cys. Try. |
|
| Met | ||
Не вдаваясь в подробности, необходимо указать на некоторые из связей биосинтеза аминокислот, которые показывают его большую сложность. В исследованиях с использованием изотопов выявилось тесное родство между глутаминовой кислотой, аргинином, пролином и гидроксипролином. Однако природа ферментативных реакций, ведущих к синтезу пролина и аргинина, была определена не полностью. Кроме того, известно, что биосинтез лизина проходит через а-кетоглутаровую кислоту, аспарагиновая кислота преобразуется в гомосерин, который в свою очередь образует треонин, изолейцин и метионин. Серии и гликокол легко взаимозаменяются под воздействием дрожжей. Известно, что синтез гистидина происходит за счет аденозинфосфата; менее точные данные имеются о синтезе ароматических аминокислот.
Ассимиляция и использование аминокислот подвержены воздействию многих факторов, и в частности температуры и степени аэрации культуры. Например, пролин, который не используется в анаэробиозе, может быть использован в брожении с доступом воздуха. Различные виды дрожжей по-разному ассимилируют аминокислоты. Ассимиляция аминокислот может служить тестом в классификации Saccharomyces (Бреди, 1965).
Риберо-Гайон и Пейно (1966) составили табл. 7.12 с классификацией аминокислот в зависимости от различных аспектов их азотного метаболизма.
Из анализа данных табл. 7.12 Риберо-Гайон и Пейно сделали следующие выводы.
Аминокислота в среде может интенсивно поглощаться дрожжами, при этом не наблюдается ни более сильного роста их, ни более сильной концентрации аминокислоты в их клетках в дальнейшем. Очевидно, дрожжи не забирают аминокислоты сусла пропорционально их потребностям для образования своих белков. Таким образом, наиболее усвояемые аминокислоты не являются обязательно наиболее важными составными элементами. Помимо этого, использование той или иной аминокислоты среды колеблется в зависимости от того, представляет ли она единственный источник азота или находится в составе смеси или же в присутствии аммиачного азота. Ярким примером является аргинин: дрожжи плохо усваивают его, когда он представляет собой единственную аминокислоту среды, и, наоборот, очень хорошо усваивают, когда он находится в смеси; в присутствии катиона аммония дрожжи его больше не используют»
Когда в питательной среде содержится смесь всех аминокислот, что предоставляет дрожжам все возможности для выбора, масса дрожжей значительно больше, чем при нахождении в среде только соли аммония. Но в естественной среде выход дрожжей еще больше.
Некоторые аминокислоты (гликокол, цистеин), хотя и широко используемые, обеспечивают образование лишь незначительной массы дрожжей. Они легко усваиваются, легко трансаминируются, но как бы в одном направлении. Следовательно, различие между ассимиляцией, т. е. потреблением, фиксацией аминокислот клеткой и питанием, т. е. использованием их для синтеза живых клеток, является оправданным. Впрочем, существует также и обратный пример: пролин и серии усваиваются плохо, но способны обеспечить создание относительно высоких масс дрожжей.
Содержание аминокислот в дрожжах
Протеиды могут составлять больше половины сухой массы дрожжей. Лишь небольшая часть общих аминокислот в клетке находится в свободном состоянии и может быть легко экстрагирована при кипячении (от 10 до 20%) наряду с небольшим количеством аммиачного азота (около 8% общего азота). Большая часть остатка приходится на белки ферментов протоплазмы. Наконец, азот пуриновых оснований нуклеиновых кислот составляет от 10 до 12% общего азота.
В табл. 7.13 объединены несколько примеров (Риберо-Гайон и Пейно, 1966). Для каждой взятой аминокислоты указана масса в процентах от общего количества белков. Данные каждой колонки в табл. 7.13 относятся к различной питательной среде, включающей одну аминокислоту (за исключением первой колонки). Из этой таблицы видно, что дрожжи способны синтезировать все белки своих клеток из любого источника азота — будь то одна аминокислота или сложная смесь.
В этих опытах содержание каждой аминокислоты в дрожжах заметно колеблется в зависимости от состава питательной среды.
Содержание некоторых аминокислот в дрожжах в зависимости от их азотистого питания (по Риберо-Гайону и Пейно, 1966), % к массе белка
Аминокислоты в пигательиой среде | Аминокислоты в дрожжах | ||||||
Arg. | Asp. | Gly. | His. | Led. | Zls. | туг. | |
Смесь аминокислот | 3,6 | 6,0 | 6,2 . | 1,4 | 6,3 | 11,8 | 3,0 |
Аргинин | 11,4 | 6,3 | 5,8 | 0,9 | 5,8 | 8,4 | 2,1 |
Аспарагин | 3,3 | 10,5 | 6,4 | 0,9 | 7,5 | 10,6 | 2,9 |
Глицирин | 3,4 | 13,0 | 10,6 | 0,4 | 10,2 | 4,6 | 1,4 |
Гистидин | 3,4 | 5,6 | 4,5 | 24,2 | 5,2 | 5,8 | 2,1 |
Лейцин | 3,5 | 9,6 | 5,5 | 1,6 | 6,5 | 11,5 | 3,5 |
Тирозин | 2,2 | 7.1 | 6,2 | 1,0 | 7,6 | 9,0 | 5,8 |
Примечание. Выделены наиболее характерные зиачения.
Некоторые аминокислоты, когда они используются в качестве единственного источника азотного питания, оказываются в дрожжах в пропорциях, намного превосходящих обычные. Например, содержание в дрожжах метионина или гликокола удваивается, тирозина или аргинина утраивается; количество цистеина и гистидина увеличивается еще больше. Эти результаты подтверждают факт прямой ассимиляции аминокислот среды путем реакции, о которой сообщил Торн.
Данное явление особенно четко прослеживается у некоторых аминокислот. Другие аминокислоты, которые при использовании в чистом виде находятся в дрожжах в нормальной пропорции или не подвергаются прямой ассимиляции, или легко трансаминируются. Это относится к лейцинам, серину, глутаминовой кислоте, метионину, триптофану. Таким образом, можно обогащать любую клетку селективно некоторыми аминокислотами, культивируя ее на среде, где они присутствуют одни, без смешения с другим, но такое обогащение возможно не для всех аминокислот. Некоторые из них (аргинин, серии, валин) вызывают мало изменений в нормальном составе азотистых веществ в дрожжах, когда они применяются индивидуально. Из этих различных азотистых компонентов дрожжи синтезируют точно такие же пропорции аминокислот, как если бы в среде была сложная их смесь, и, наоборот, другие аминокислоты, как гликокол и триптофан, вызывают глубокие изменения в обычном составе азотистых веществ в дрожжах. Наконец, некоторые аминокислоты повышают процентное содержание в дрожжах других аминокислот.
Выделение аминокислот живыми и мертвыми дрожжами
Всегда отмечают большое разнообразие в составе амидного азота перебродивших сред, в которых дрожжи в начале брожения располагают лишь одним источником азота. Живые дрожжи в период роста высвобождают аминокислоты как продукты жизнедеятельности. Табл. 7.12 (графа 6) дает перечень аминокислот, более всего выделяемых дрожжами. Отмечено значительное выделение аминокислот, когда источником азотного питания является аммиак или, еще лучше, аммиак и аспарагин. В первом случае выделяются 10 аминокислот, которые в сумме дают 31 мг/л аминного азота, во втором—18 аминокислот, дающих 206 мг/л аминного азота. Следовательно, основная среда, содержащая при забраживании лишь одну аминокислоту, представляет после брожения более или менее изменчивую гамму аминокислот, синтезированных и выделенных дрожжами
Две аминокислоты высвобождаются дрожжами почти одинаковым образом независимо от природы присутствующего источника азота: глутаминовая кислота в значительных дозах (может достигать сотни мг/л) и в меньшем количестве серии; именно эти две аминокислоты находятся в дрожжах в больших концентрациях.
Иногда констатируют высвобождение соли аммония, например при использовании аргинина. Такое увеличение содержания аммиака не наблюдается в натуральных средах, где дрожжи располагают разнообразным азотным питанием.
Эти важные явления выделения аминокислот живыми дрожжами не следует путать с не менее важными явлениями, при которых мертвые клетки медленно отдают в жидкость аминокислоты, синтезированные ими во время своего роста. В то время как выделение живыми дрожжами селективно и нет какого-либо количественного отношения между выделенными аминокислотами и их концентрацией в дрожжах, что хорошо видно из сравнения данных в графах 5 и 6 табл. 7.12, у аминокислот, выделяющихся мертвыми дрожжами, такая пропорциональность хорошо выражена. Это наиболее важные компоненты дрожжей, за исключением пролина. Пу и Урнак (1970) доказали выделение пептидов мертвыми дрожжевыми клетками.
Дюпюи и сотрудники (1967) указали на различие между автолизом, или ферментативным разложением макромолекул азотистых веществ внутренними ферментами отмершей клетки, и простым выделением или растворением веществ, входящих в состав клетки, в то время, когда вино находится на дрожжевом осадке. Было бы важно уточнить природу этих явлений, особенно в технологии производства шипучих вин.
Может возникнуть вопрос, влияют ли изменения в азотном метаболизме дрожжей на качество вина. На современном уровне наших знаний трудно дать однозначный ответ. Образование высших спиртов способствует аромату вин, но интенсивность и тонкость аромата не связаны с их содержанием. Аминокислоты, за исключением глутаминовой кислоты, придающей характерный горько-соленый привкус, по-видимому, не оказывают прямого влияния на вкус, но с другой стороны, аминокислоты, нуклеотиды, витамины, выделяемые дрожжами в вино после окончания брожения, могут способствовать росту бактерий яблочно-молочного брожения.
Влияние кислотности на развитие дрожжей
Практики нередко имеют ложное представление о роли кислотности сусла в процессе брожения. Обычно они говорят: «Хорошая кислотность помогает брожению». Некоторые думают, что дрожжи лучше развиваются, легче и вполне трансформируют сахар, когда сусло содержит больше кислот. В действительности повышенная кислотность не способствует росту, а наоборот, дрожжи сбраживают больше сахара в нейтральной, чем в кислой среде. Считают, что оптимальная зона рН для роста дрожжей находится между 4,0 и 6,0. Однако реальная кислотность виноградных сусел колеблется от рН 3,0 до рН 3,8 в зависимости от районов виноделия или условий созревания винограда. При этих значениях кислотности винные дрожжи развиваются очень хорошо. При рН от 2,8 до 2,5 или 2,6, редко встречающихся в натуральных средах, брожение становится затрудненным. Рост дрожжей также замедляется в слегка щелочной среде, следовательно, дрожжи выносят большие колебания кислотности, но не без нарушения своих механизмов брожения; точно так же значительно изменяется образование глицерина и других вторичных продуктов в зависимости от рН бродящей среды.
В гл. 13 будет показано, что когда брожение останавливается (это возможно в жаркие годы) из-за недостаточной аэрации или чрезмерно высокой температуры и в красном вине остается несброженный сахар, то это происходит не из-за недостаточной кислотности винограда. Но слабая кислотность может сделать последствия такой остановки более тяжелыми, так как бактерии молочнокислого брожения развиваются тем легче, чем слабее кислотность, следовательно, роль кислотности в виноделии следует понимать таким образом, что она не способствует развитию дрожжей, а подавляет опасные бактерии в случае остановки брожения.

