Этот фермент (O2 = оксидоредуктаза К.Ф. 1.10.3.1) является одним из наиболее активных, встречающихся в ягодах винограда. Фермент обладает способностью катализировать окисление не только катехинов, но и других фенольных соединений, содержащих 1-2- и 1-3-оксигруппу (ОН), пирокатехин и пирогаллол, а также группу NH2 (ароматические аминокислоты и амины).
о-Дифенолоксидаза представляет собой белок, в простетической группе которого содержится от 0,2 до 0,3% меди. Исследования показали, что медь, входящая в состав о-дифенолоксидазы, сохраняется в закисном состоянии, как в отсутствии субстрата при доступе кислорода, так и в присутствии субстрата (пирокатехина) в атмосфере аргона и СO2.
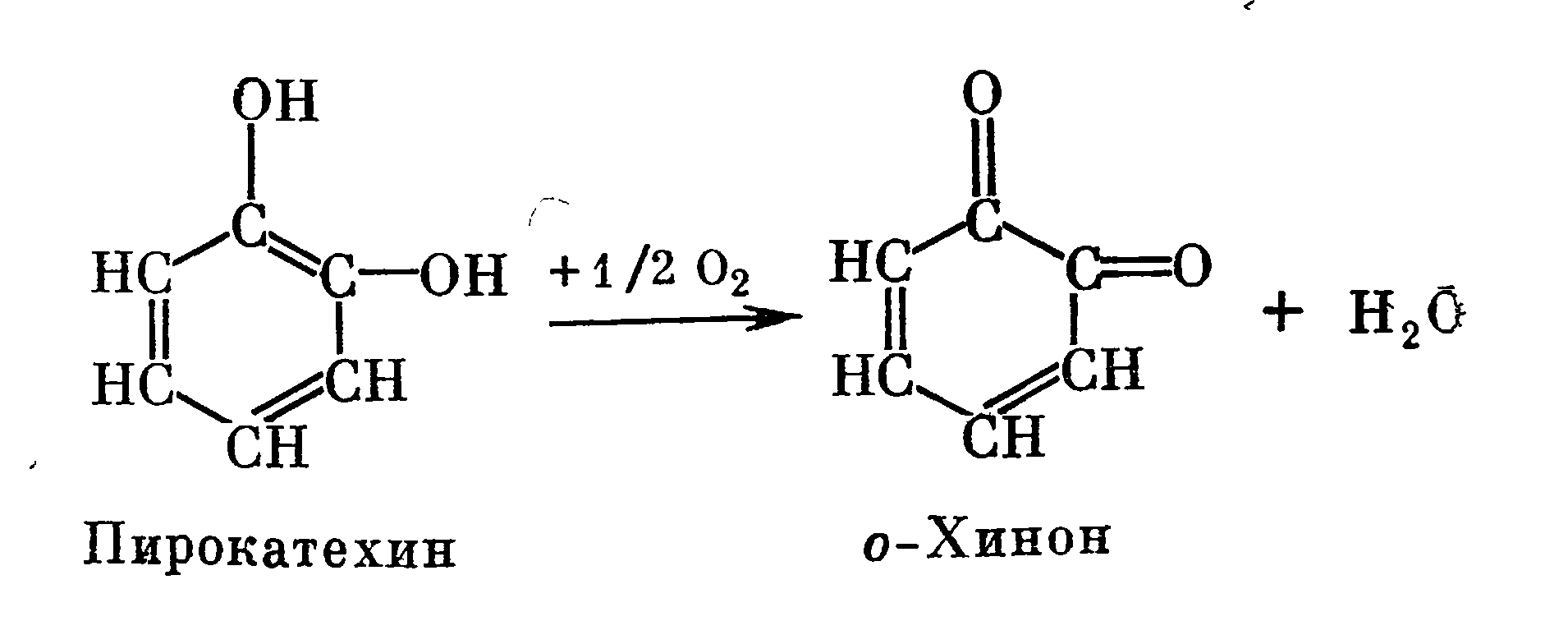
Так, в 1965 г. Д. Картез показал, что медь в о-дифенолоксидазе находится в восстановленной форме как в ходе ферментативной реакции, так и в состоянии покоя. Однако другие авторы считают, что основное действие о-дифенолоксидазы состоит в обратимом окислении одновалентного атома Сu+ в двухвалентный Сu2+. Окислительное действие о-дифенолоксидазы заключается в дегидрировании орто-дифенолов с образованием орто-хинонных форм.
Характерной особенностью о-дифенолоксидазы является способность катализировать Две реакции — окисление дифенолов и гидроксилирование монофенолов. Следовательно, о-дифенолоксидаза является не единственным ферментом, обладающим смешанными функциями. Таким же свойством обладает риболозодифос- фаткарбоксилаза.
В реакции гидроксилирования ОН-группа вводится в молекулу субстрата в орто-положении. Этот процесс необходим для того, чтобы превратить монофенолы в дифенолы, так как о-дифенолоксидаза окисляет дифенолы.
О механизме реакций, осуществляющих орто-гидроксилирование монофенолов, существует несколько мнений. Д. Картез считает, что превращение монофенолов в орто-дифенолы осуществляется с участием свободных ионов Сu2+, не связанных с белком, причем в роли активного гидроксилирующего агента выступает хинон, согласно схеме:
![]()
По мнению Э. Мэзона (1966), о-дифенолоксидазная активность определяется ионами меди, находящимися в окисленной форме Си2+, т. к. проявление крезолазной активности не обусловлено наличием восстановленной формы меди Сu+. Это подтверждается тем, что процесс внедрения второй оксигруппы в молекулы монофенолов осуществляется, как правило, действием о-дифенолоксидазы в присутствии восстановителей (аскорбиновая кислота, НАД-Н2 и НАДФ-Н2).
о-Дифенолоксидаза ингибируется диэтилдитиокарбоматом; это свидетельствует о том, что фермент содержит в простетической группе ион меди. Медь вступает в химическое соединение с диэтилдитиокарбоматом, который блокирует активную группу фермента, в связи с чем сам фермент теряет активность. Однако, диэтилдитиокарбомат ингибирует также аскорбатоксидазу, поэтому их трудно различить. Исходя из этого, для идентификации о-дифенолоксидазы применяют купреин, который является специфическим только для о-дифенолоксидазы. Этот фермент также ингибируется дихлордифлюрометаном.
В виноделии для прекращения окислительных процессов о-дифенолоксидазу обычно ингибируют введением сернистого ангидрида или нагреванием.
Впервые о-дифенолоксидаза была выделена из картофеля Ф. Кубовице, а затем из листьев чайного куста М. А. Бокучавой и др., а из винограда С. В. Дурмишидзе и А. К. Родопуло. Недавно М. Кидрон, Е. Харель и А. Мауер [124] выделили о-дифенолоксидазу из винограда. Этот энзим был очищен 334 раза с выходом 30%. Его молекулярная масса 80 000D определена методом седиментации. Содержание меди не превышает одного атома на одну молекулу фермента, о-Дифенолоксидаза в большом количестве содержит аспарагиновую кислоту, затем глютаминовую, пролин и аланин.
о-Дифенолоксидаза найдена в хлоропластах и митохондриях листьев винограда. Удельная активность ее в хлоропластах в 4 раза больше, чем в митохондриях [70].
Механизм инактивации о-дифенолоксидазы все еще не выяснен. Одни авторы считают, что в результате действия фермента на полифенолы образуются хиноны, которые являются токсичными веществами, потому что дубят белки, и фермент, являясь белком, инактивируется. Другие считают, что о-дифенолоксидаза быстро окисляет пирокатехин и инактивируется продуктами его окисления. Некоторые утверждают, что механизм инактивации заключается в том, что хиноны взаимодействуют со свободными аминогруппами фермента и он при этом инактивируется.
Исследования X. Робертса и Ф. Вуда, проведенные в 1955 г. показали, что при действии о-дифенолоксидазы на пирокатехин количество поглощенного кислорода составляло до двух атомов на одну молекулу.
На основании этого можно было считать, что реакция окисления пирокатехина протекает следующим образом:
![]()
Между тем известно, что перекись водорода не образуется. Исходя из этого можно утверждать, что реакция протекает по схеме
I
Как видно, эта ферментативная система является одной из главных окислительных систем, катализирующих конечный этап оксибиотического процесса.
За последнее время многие ученые отрицают роль о-дифенолоксидазы как терминальной дыхательной системы. Одним из аргументов того, что этот фермент не участвует в нормальном процессе дыхания, является отсутствие его сопряжения с системой запасания энергии. Так, при окислении НАД-Н2 в о-дифенолоксидазной системе макроэргические связи не образуются и клетки теряют эту энергию. Исходя из этого считают, что в дыхании растений завершающим ферментом является цитохромоксидаза.
Наиболее подробно активность о-дифенолоксидазы изучали Η. М. Сисакян, И. А. Егоров и Б. Л. Африкян (1948), С. В. Дурмишидзе [29], А. К. Родопуло [75]. Эти авторы нашли в армянских и грузинских сортах винограда о-дифенолоксидазу, активность которой в процессе вегетации виноградной лозы и созревания ягод винограда увеличивается.
В настоящее время известно, что большинство ферментов существуют в одном и том же организме в виде молекулярных «форм, т. е. в виде изоэнзимов. Этому явлению придают большое биологическое значение. о-Дифенолоксидаза является полиморфным ферментом с двойной функцией. Она катализирует ортогидроксилирование монофенолов и окисление оргодифенолов.
С. В. Дурмишидзе, О. Т. Хачидзе, Г. И. Пруидзе [30] методом диск-электрофореза в полиакриламидном геле исследовали изоферментный состав о-дифенолоксидазы в разных органах виноградной лозы. Интересным является изменение состава изоферментов о-дифенолоксидазы по фазам развития гроздей. Так, например, при завязывании ягод сорта Ркацители было обнаружено 3, а в гребнях 6 изоферментов. В фазе роста в семенах и кожице изоферментный состав меняется. В кожице винограда появились новые изоферменты.
Для изучения субстратной специфичности о-дифенолоксидазы были выделены фракции и испытаны на окирление фенолов. Вторая фракция окисляет хлорогеновую и кофейную кислоты, (+) катехин и пирокатехин с большей скоростью, чем остальные фракции. Выделенные фракции изоферментов о-дифенолоксидазы не катализируют окисление n-фенилендиамина, I-тиразина, n-крезола, т. е. С. В. Дурмишидзе и его сотрудники показали, что о-дифенолоксидаза встречается во всех органах виноградной лозы в виде разных изоферментов.
В. Вольф [180] исследовал изоэнзимы о-дифенолоксидазы в зеленых и спелых ягодах винограда сорта Каберне Совиньон. Им было найдено шесть изоферментов, обладающих разной ферментативной активностью.
Также показано, что с момента появления ягод до полного их созревания активность о-дифенолоксидазы и количество фенольных соединений быстро уменьшается в течение одного месяца, т. е. с того момента, как масса ягод и сахаристость увеличиваются.

