Известно, что ферменты участвуют в катализе биохимических реакций. Для осуществления своей каталитической активности некоторые из них нуждаются в кофакторе, которым могут быть в зависимости от случая ион металла, прочно связанная простетическая группа, не отделимая от ферментного белка, или кофермент, несвязанный с белком, он ведет себя как субстрат реакции. Ниже будут описаны четыре кофактора, которые играют важную роль в механизмах брожений.
Никотинамидадениндинуклеотид, или НАД. Его структура включает два нуклеотида, связанных пирофосфатной связью (рис. 15.1). В течение длительного времени его называли дифосфопиридиннуклеотид, или ДПН. Он выступает как кофермент различных дегидрогеназ; фактически может фиксировать два водорода посредством своего никотин амидного ядра (рис. 15.2). Этот окислительно-восстановительный процесс кратко записывается так:
NAD^ + 2Н^NADH 4- Н+, или проще, но менее верно NAD + 2Н NADH2.

Рис. 15.2. Механизм окисления-восстановления НАД.
Аденозиндифосфат, или АДФ, и аденозинтрифосфат, или АТФ. Эти вещества играют главную роль в процессах передачи энергии в биохимических реакциях. В молекуле АТФ (рис. 15.5)
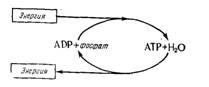
Рис. 15.6. Роль АТФ в энергообмене.

Рис. 15.3. Окисление-восстановление, катализируемое НАД.
Рис. 15.5. Аденозинтрифосфат, или АТФ.

Рис. 15.4 Тиаминпирофосфат
Реакция окисления-восстановления, в которой первое вещество АН2 окисляется в форме А, тогда как второе В восстанавливается в ВН2, схематически показана на рис. 15.3.
Тиаминпирофосфат (ТРР), или кокарбоксилаза. Сложный пирофосфорный эфир тиамина или витамин Bi (рис. 15.4) является переносчиком альдегидных групп, и в частности ацетальдегида.
третья молекула фосфата связана с предыдущей так называемой «энергоемкой» связью, т. е. разрыв этой связи сопровождается высвобождением энергии; в то же время для образования такой связи необходима внешняя энергия. Схематически этот процесс можно представить так, что химические реакции, при которых высвобождается энергия (экзореакции), ведут к образованию из АДФ и минерального фосфата молекул АТФ, которые являются формой накопления непосредственно используемой энергии (рис.
- . Эти АТФ в дальнейшем снова используются для реализации реакций синтеза и других реакций, нуждающихся в энергии (эндореакции), необходимой клеткам, чтобы обеспечить их жизненные функции, и в частности их размножение.
Кофермент А. Этот фактор (рис.
- кратко записывается как СоА— —SH; такая запись указывает на химическую группу тиола (SH), которая является основой всех его свойств. Он дает с кислотами ацилкоферменты А, в сокращенной записи R—СО—S— —СоА, очень реакционно способные и обеспечивающие фиксирование радикала R—СО на другой молекуле. Он также участвует во многих реакциях синтеза, в частности в форме СНз— —СО—S—СоА, или ацетилкофермента или активного ацетата, лежит в основе синтеза жирных кислот и липидов.

Рис. 15.7. Кофермент А.
Гликолиз включает совокупность реакций, которые позволяют живым клеткам превращать сахар С6 (глюкоза и фруктоза) в пировиноградную кислоту. Эти реакции одинаково успешно протекают как в анаэробиозе (спиртовое брожение и молочнокислое брожение), так и в аэробиозе (дыхание). Ввиду этого они описаны отдельно, прежде чем приступить к рассмотрению явлений микробиальной биохимии, интересующих энологию, из которых многие вызывают гликолиз.
Первым этапом является образование сложных эфиров фосфорной кислоты сахаров (глюкозы или фруктозы) (рис. 15.8), обычный процесс в биохимических механизмах, который объясняется энергетическими причинами; действительно, молекулы фосфата могут делать с некоторыми органическими радикалами «связи, насыщенные энергией», и их передача с одной молекулы на другую сопровождается передачей энергии в соответствии с процессом, описанным для АТФ. Руководствуясь установившейся традицией, авторы обозначают во всех формулах молекулы фосфата символом Р.
Как у глюкозы, так и у фруктозы исходным пунктом разрыва молекулы является фруктоза-1,6-дифосфат, который обладает фурановым циклом с 5 малостабильными цепями. Разрыв ведет к двум изомерным триозам: 96,5% диоксиацетонфосфата и 3,5% глицеринового альдегидфосфата (рис. 15.9). Но лишь последний участвует в последующих реакциях, и равновесие непрерывно нарушается в его пользу. В конечном счете все происходит так, как если бы одна молекула сахара С6 превращалась в две молекулы глицеринового альдегида (см. рис. 15.8 и 15.9).
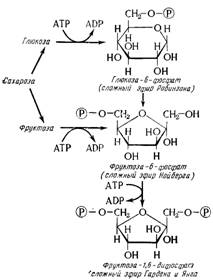
Рис. 15.8. Образование сложных эфиров фосфорной кислоты и сахаров.
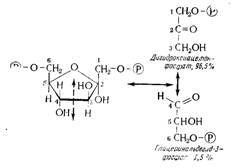
Рис. 15.9. Разрыв фруктозы-1,6-дифосфата на две молекулы триозофосфата в процессе гликолиза.
Превращение глицеринальдегида-3- фосфата в пировиноградную кислоту (рис. 15.10) включает окисление в глицериновую кислоту после гидратации, изомеризацию с передачей фосфатной группы, дегидратацию спиртовой функции в энолпировиноградную кислоту.
Окисление глицеринальдегида-З- фосфата, с одной стороны, отделение молекулы фосфата от фосфоэнолпировиноградной кислоты, с другой, представляют собой реакции, которые высвобождают энергию, использованную на образование АТФ. Следовательно, превращение двух молекул глицеринальдегида-3-фосфата, происходящих из одной молекулы сахара С6, ведет к образованию 4АТФ. Но начальное фосфорилирование молекулы сахара С6 требует 2АТФ (см. рис. 15.8). В конечном счете чистым энергетическим балансом гликолиза является образование 2АТФ.

