Глава 12. УСЛОВИЯ РАЗВИТИЯ И АКТИВНОСТИ МОЛОЧНЫХ БАКТЕРИЙ ВИНА
СПОСОБЫ ИССЛЕДОВАНИЯ РОСТА БАКТЕРИЙ
Бактериальная популяция определяется двумя параметрами: микробиальной плотностью, т. е. массой клеток на единицу объема, и клеточной концентрацией, т. е. числом клеток на единицу объема. Возрастание этих двух параметров отражает рост бактерий. Масса клеток выражает массу синтезированного органического вещества, концентрация — число клеточных делений. В гл. 7 было показано на примере дрожжей, что для роста микроорганизмов необходимо сочетание определенного числа факторов и условий.
Понятие «ограничивающий фактор» было определено в гл. 7, как любой фактор, отсутствие или недостаток которого влекут за собой остановку роста. Определены также различные фазы роста: скрытое состояние, ускоренное развитие, экспоненциальная или логарифмическая фаза, замедление, устойчивая фаза и отмирание (см. рис. 7.1).
Подсчет общего количества клеток и числа живых клеток
Для исследования размножения и активности молочнокислых бактерий можно использовать способы, аналогичные тем, какие применяют в отношении дрожжей. Метод прямого подсчета клеток с помощью гематиметра Маласеза может также применяться к бактериям, используя увеличение в 600 раз; подсчет стрептококков или стрептобацилл остается приблизительным, так как невозможно подсчитать элементы цепочек; в зависимости от их длины результаты могут иметь большие расхождения. Кроме того, можно определять число бактерий по отношению к дрожжам, которые легче поддаются подсчету, например, в молодом вине.
Камера счетчика клеток Салумбини разделена на 400 маленьких квадратных чашечек глубиной 0,04 мм и площадью 0,0025 мм2, т. е. объемом 1/10 000 мм3 каждая. Бактериальная суспензия фиксируется на формальдегиде и окрашивается метиленовой синью; через 5 мин покоя суспензию рассматривают под микроскопом. Трудности представляют наводка на фокус и определение местонахождения бактерий. Наряду с другими исследованиями авторы отказались от метода прямого подсчета и предпочли способ, основанный на нефелометрических измерениях с эталонированием по массе.
Известно отношение между мутностью бактериальных суспензий и сухой массой бактерий; однако форма, в зависимости от того, кокки это или бациллы, и величина клеток могут исказить истинную картину. При очень тщательной работе в одних и тех же условиях среды, окраски и т. д. помутнение, измеренное нефелометром, можно выразить в сухой массе бактерий, находящихся в состоянии суспензии, в соответствии с заранее построенным графиком (Меламед, 1962). Для удобства работы можно использовать одну и ту же кривую для всех бактерий, хотя и существуют расхождения (в среднем около 10%) между бактериями различной формы. На рис. 12.1 представлена кривая среднего типа. В табл. 12.1 приведены отношения между массой бактерий и числом клеток для двух молочнокислых бацилл; в табл. 12.2 показано влияние формы и величины бактерий на определение методом нефелометрии.
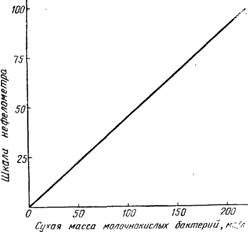
Рис. 12.1. Калибровочная кривая зависимости между сухой массой бактерий молочнокислого брожения в суспензии и оптической плотностью, определенной прямым отсчетом на шкале нефелометра.
Число живых бактерий определяют путем подсчета на чашках Петри. Этот способ труднее реализовать, и он менее точен, чем при работе с дрожжами. Он позволяет приближенно вычислять «жизнеспособность» культур, но не может быть мерой их реального роста. Размножаются не все живые клетки, а некоторые колонии могут возникнуть из групп клеток. Такой метод, который позволил, например, следить за поведением молочнокислых бактерий, введенных в вино, дает лишь сравнительные результаты. Когда живые бактерии находятся в большом объеме жидкости (например, в осветленных винах), предпочтительно использовать фильтрующие мембраны; нужно, чтобы состав питательной среды, на которую помещают мембрану, подходил для развития молочнокислых бактерий вина; работу проводят в атмосфере углекислого газа (Пейно и Сапис-Домерк, 1972).
Эволюция молочнокислых брожений
За развитием культуры можно также следить путем периодического определения одного из поглощаемых или образуемых элементов. В случае молочнокислого сбраживания сахаров определяют молочную кислоту или, что проще, увеличение общей кислотности. При яблочно-молочном брожении вина можно проследить исчезновение яблочной кислоты, применяя хроматографию или количественный микробиологический, или энзиматический анализ; можно, наконец, определять количество углекислого газа манометрическим методом или применением специального электрода (Лонво, 1975).
Отношение между мутностью бактериальной суспензии и формой и величиной клеток
Вилы бактерий | Приблизительные размеры, мкм | Масса бактерий (в мг/л), вызывающих одно и ТО же значение помутнения (75 делений нефелометра) |
Средние кокки | 0,8 | 3,62 |
Большие кокки | 1,2 | 3,17 |
Малые стрептококки | 0,6 | 3,35 |
Бациллы |
|
|
короткие | 0,5-1,0 | 3,75 |
длинные, тонкие | 0,5-5 | 3,25 |
длинные, толстые | 0,6-3 | 3,25 |
Таблица 12.1
Отношение между массой молочнокислых бактерий Lactobacillus hilgardii и числом клеток
Штаммы бактерий | Число клеток на 1 см* | Влажная масса,* мг/л | Число клеток на 1 мг влажной массы | Сухая масса, мг/л | Число клеток на 1 мг сухой массы |
Штамм ВС 2 Штамм ВZ 14 | 3,1-108 | 5970 | 5,2-107 | 335 | 9,5-108 |
*Масса остатка от центрифугирования, после обезвоживания.
Таблица 12.2
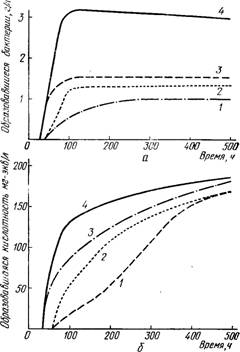
Рис. 12.2. Эволюция роста бактерий, определенная:
а — по сухой массе бактерий, образовавшихся во время молочнокислого сбраживания сахаров; б — по увеличению кислотности во время молочнокислого сбраживания сахаров: 1 — Реdiococcus cerevisiae; 2 — Leuconostoc oinos A+; 3 — Lactobacillus casei; 4 — Lactobacillus hilgardii.
При изучении молочнокислого брожения полной содержащей сахар питательной среды (разбавленное виноградное сусло, обогащенное 5 г/л дрожжевого экстракта и доведенного до рН 4,4), засеянной бактериями, выделенными из вина, в количестве от 30 000 до 50 000 на 1 см3 при температуре 25° С (рис. 12.2), можно сделать следующие замечания:
а) помутнение, которое можно измерить, проявляется через 24—48 ч после засева; при прочих равных условиях скрытая фаза более продолжительна у кокков; гетеро- или гомоферментативный характер бактерий не оказывает на этот фактор никакого влияния;
б) максимальной численности популяция достигает у молочнокислых бацилл через 4 дня, у кокков за 8— 12 дней;
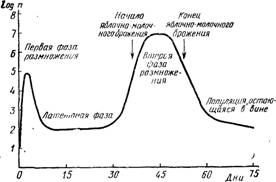
Рис. 12.3. Схема эволюции роста бактерий и яблочно-молочного брожения при виноделии по красному.
в) урожаи бактерий выше у гетероферментативных видов; массовые значения образующихся гетероферментативных бацилл в 2 раза больше, чем у гомоферментативных бацилл;
г) образование кислотности начинается не сразу; жидкость непрозрачна, в то время как еще не образовалась концентрация кислотности, достаточная для количественного определения;
д) образование кислотности происходит интенсивно после того, как популяция. достигнет стационарной фазы; кислотность может удвоиться, начиная с момента, когда констатируют максимальный рост бактерий. По истечении 20 дней подкисление все еще продолжается. Не отмечается параллелизма, который существует, например, между спиртовым брожением и размножением дрожжей. Бактерии растут быстрее, чем дрожжи, но имеется расхождение, разрыв между образованием молочной кислоты и ростом;
е) максимальные значения образующейся кислотности у различных бактерий мало различаются между собой, во всяком случае, они менее изменчивы, чем максимальные значения массы бактерий.
Когда анализируют процесс спонтанного роста бактерий с момента начала переработки винограда посредством указанных выше количественных способов, обычно различают два последовательных цикла роста, которые схематически отражены на рис. 12.3. Первый начинается в первые часы брожения на мезге и протекает параллельно с развитием дрожжей; размножение бактерий прекращается с образованием спирта, и популяция бактерий претерпевает очень сильное уменьшение. Число живых клеток, остающихся в новом вине после спиртового брожения, может сильно колебаться. Веч (1973) сообщает, что у швейцарских вин это число колеблется от 100 до 80 000 на 1 см3; 2/3 вин имеют свыше 10000 живых бактерий на 1 см3. Следующий за этим латентный период является более или менее длительным. В отдельных редких случаях могут быть совмещения по времени спиртового и яблочно-молочного брожения, что нежелательно; чаще всего латентный период длится несколько дней или несколько недель, если при этом выступает какой-либо ограничивающий фактор (сернистый ангидрид, неблагоприятная температура); скрытый период может продолжаться в течение нескольких месяцев.
После этой фазы размножение возобновляется и вызывает сбраживание яблочной кислоты. На первой стадии образование молочной кислоты идет слабо. Яблочно-молочное брожение проявляется некоторой задержкой размножения клеток. Разложение яблочной кислоты начинается только тогда, когда рост достигает логарифмической фазы; оно продолжается во время стационарной фазы и даже в фазе замедления. Когда популяция слаба, яблочная кислота не расходуется. Похоже, что численность популяции должна превзойти 1 млн. клеток на 1 см3, чтобы яблочно-молочное брожение действительно началось. Фактически речь идет не о настоящем брожении, поскольку оно не является источником энергии.
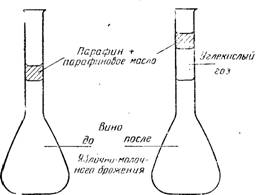
Рис. 12.4. Приспособление, позволяющее экспериментально обнаружить начало яблочно-молочного брожения благодаря образующемуся пузырьку углекислого газа.
Затем после исчезновения яблочной кислоты популяция уменьшается более или менее быстро, и наконец в вине остается популяция живых клеток, численность которой зависит от их рН, степени сульфитации, способов осветления (Мартиньер и сотрудники, 1974).
Чтобы проследить эволюцию яблочно-молочного брожения, в лабораторных условиях было использовано следующее приспособление. Засеянную питательную среду или вина, подлежащие исследованию, помещали в колбы вместимостью 100 или 200 см3 с длинной тонкой калиброванной шейкой. Их наполняют до калибровочной метки и закрывают толстым слоем смеси, состоящей на 2/3 из парафина и на 1/3 из парафинового масла, которую сжижают легким нагреванием. Затем колбы ставят в термостат при 25° С. При этой температуре смесь затвердевает и сохраняет консистенцию пасты. Такое приспособление позволяет наблюдать пузырек углекислого газа, образующийся под парафиновой пробкой, и фиксировать его объемы, которые заставляют пробку подниматься вверх по горловине колбы (рис. 12.4). Исследуемые среды предварительно очищают от углекислого газа путем взбалтывания под вакуумом. Затем во избежание вмешательства дрожжей в вино вводят актидион из расчета от 2 до 5 мг/л. Система обтюрации действует надежно только при температуре 25° С.
Этот способ особенно чувствителен для определения момента начала яблочно-молочного брожения и позволяет быстро делать большое число сравнений. Этот способ применим и тогда, когда хотят оценить шансы еще кислого вина подвергнуться спонтанному яблочно-молочному брожению; для этого образец шина, помещенный в такую колбу, ставят в термостат и следят за появлением первого пузырька под парафином. Следует подтвердить аналитически исчезновение яблочной кислоты и титруемой кислотности, так как образование углекислого газа даже без участия дрожжей, нельзя рассматривать как явление специфическое для яблочно-молочного брожения.
Чтобы точнее проследить этот феномен, можно использовать углекислотный электрод, который позволяет количественно определять углекислый газ, растворенный в жидкости (Лонво и Риберо-Гайон, 1973); углекислый газ диффундирует через тефлоновую мембрану в электролит, вызывая изменение рН, которое регистрируется. Эти авторы воспользовались аппаратом, созданным для количественного анализа углекислого газа в крови; результаты, выраженные в величинах парциального давления, могут быть представлены в виде концентрации на 1 л.

