Ферментативную активность экстракта (концентрацию содержащегося в нем активного фермента) измеряют по скорости реакции катализированной этим ферментом. Действительно, если все другие факторы (рН, температура, концентрация кислорода) являются постоянными, скорость реакции пропорциональна концентрации фермента. Основными методами определения активности являются:
1) спектрофотометрическое измерение скорости появления окрашенного продукта, образованного ферментативной реакцией (как функция времени);
2) измерение скорости расходования определенного количества кислорода, которое можно проводить или методом полярографии с помощью кислородного электрода Кларка или же с помощью манометра на аппарате Варбурга;
3) измерение скорости окисления введенного возбудителя восстановления, чаще всего аскорбиновой кислоты.
К наиболее применяемым методам относятся спектрофотометрический и полярографический; другие же характеризуются или недостаточной чувствительностью (манометрическое измерение), или подходят для измерения только слабых активностей (скорость исчезновения аскорбиновой кислоты).
Спектрофотометрический метод является простым, быстрым и воспроизводимым. Однако в некоторых случаях его нельзя использовать (мутные жидкости). Этот метод также не обеспечивает возможности произвести сравнение различных фенольных субстратов, так как максимум поглощения и коэффициент молекулярной экстинкции образовавшихся хинонов неодинаковы.
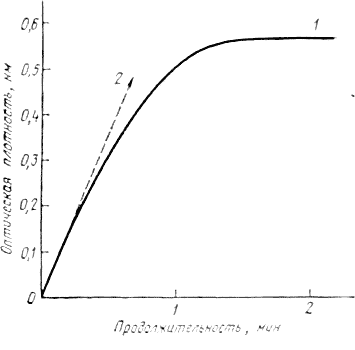
Рис. 2.1. Кривая возрастания оптической плотности при измерения активности тирозиназы спектрофотометрическим методом.
Техника выполнения заключается в том, что в стеклянную кювету спектрофотометра толщиной 1 см вводят: ( + )-катехин или метил-4-пнрокатехол 10 мМ в фосфат-цитратном буфере 0,1 М при рН 4,35—2 мл; фосфат-цитратный буфер 0,1 М при рН 4,75—0,5-—1 мл; ферментный экстракт — 0—0,5 мл.
Концентрацию кислорода фиксируют на уровне 8,1 мг/л, насыщая буферы воздухом при температуре 25°С.
Появление хинона, проявляющееся в увеличении оптической плотности при 400 им (метил-4-пирокатехол) или при 392 нм [( + )-катехин], регистрируют как функцию времени. И тогда получают тип кривой, изображенной на рис. 2.1, где горизонтальный участок кривой 1 соответствует израсходованию кислорода в среде, а начальный угол подъема кривой 2 характеризует скорость реакции.

Рис. 2.2. Схема прибора для измерения ферментативной активности полярографическим методом.
Эту скорость реакции выражают в нанометрах на 1 мл экстракта в минуту, или на 1 г свежего винограда.
Полярографический способ дает меньшую скорость выполнения, но обладает большей воспроизводимостью и позволяет использовать все фенольные субстраты, обеспечивающие возможность сравнения активности одного субстрата с другими, поскольку только он учитывает расход кислорода.
Схема прибора (рис. 2.2), включающая электрод Кларка, была использована (Дюберне, 1974) для измерения ферментативной активности. В этот прибор входит камера 3 вместимостью 10 мл, закрытая игольчатым клапаном У, который открывают при наполнении камеры. Кроме того, в зависимости от положения клапан может перекрывать или оставлять открытым канал 2. Электрод Кларка (тип ОКМ-39) входит в камеру и позволяет измерять концентрацию кислорода, растворенного в жидкой среде, находящейся в камере. Система игольчатого клапана 1 позволяет наполнять камеру жидкостью в полном объеме, не захватывая пузырьков воздуха. Поэтому измеренные изменения концентрации кислорода будут относиться только к кислороду, растворенному в жидкой среде. Намагниченный стержень 7 обеспечивает перемешивание этой среды в течение всего времени измерений, с тем чтобы избежать искусственного обеднения среды в содержании кислорода на уровне электрода, которое может возникнуть вследствие небольшого собственного поглощения кислорода, производимого этим электродом. Канал 2 позволяет после открытия вводить в камеру с помощью шприца или экстракт фермента, или любое другое вещество, действие которого на ферментативную реакцию хотят исследовать (например, ингибитор). Наконец, кожух У обеспечивает циркуляцию воды вокруг камеры. Ее можно термостатировать при температуре, избранной экспериментатором.
Кислородный электрод Кларка построен на следующем принципе. Два электрода (серебряный анод 4 и катод 5, выполненный из золота) помещены в гель (КО) и отделяются от среды, подлежащей измерению, тефлоновой мембраной б, проницаемой для кислорода. К катоду подводят постоянный ток напряжением 850 мВ, что ведет к его поляризации. Кислород, свободно проходящий через мембрану, восстанавливается на уровне катода соответственно реакции
![]()
Это восстановление сопровождается расходованием электронов, которое компенсируется на уровне анода высвобождением электронов по реакции
4Ag + 4С1- -> 4AgCl + 4<Г.
В результате образуется ток, сила которого прямо пропорциональна парциальному давлению присутствующего кислорода. Этот ток усиливают и измеряют гальванометром, градуированным в миллиграммах кислорода на 1 л.

Рис. 2.3. Кривая уменьшения концентрации кислорода по времени при измерении активности тирозиназы полярографическим методом.
Техника измерения ферментативной активности заключается в следующем.
Камеру наполняют раствором фенольного субстрата - концентрацией 10 мМ в фосфат-цитратном буфере (рН 4,75, соответствующий оптимальному рН активности тирозиназы винограда), температурой 25°С. Исходную концентрацию кислорода приводят к 8,1 мг/л, насыщая раствор воздухом при 25°С. После 1 мин стабилизации ферментативный экстракт (от 10 до 500 мкл) вводят через канал 8 с помощью шприца.
Уменьшение концентрации растворенного кислорода регистрируют через каждую минуту. В результате получают кривую, приведенную на рис. 2.3.
Исходный наклон 1 кривой 2 пока вызывает скорость реакции, отражающей ферментативную активность, которая выражается в миллиграммах кислорода, поглощаемого на 1 л реакционной среды в 1 мин и на 1 мл ферментативного экстракта.

