ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ И РЕДОКС-СИСТЕМЫ В ВИНЕ
Общие сведения об окислительно-восстановительных процессах
Вещество окисляется, когда оно связывает кислород или отдает водород; например, при сгорании серы S образуется сернистый ангидрид SO2, при окислении сернистой кислоты H2SO3 — серная кислота H2SO4, а при окислении сероводорода H2S — сера S; при окислении сульфата двухвалентного железа в присутствии кислоты образуется сульфат трехвалентного железа
![]()
или при распаде двухвалентного сульфата на анион SO4- катион Fe++ получают

или, сокращая анионы, не участвующие в реакции, находят
![]()
Последняя реакция идентична в случае окисления другой соли двухвалентного железа; она не зависит от природы аниона. Следовательно, окисление иона двухвалентного железа в ион трехвалентного железа заключается в увеличении его положительного заряда за счет иона водорода, который теряет свой заряд, образуя атом водорода, который соединяется с кислородом, чтобы дать воду. В результате при таком окислении происходит увеличение положительного заряда катиона, или, что то же самое, уменьшение отрицательного заряда аниона. Например, окисление сероводорода H2S заключается в превращении иона серы S в серу (S). В действительности в обоих случаях наблюдается потеря отрицательных электрических зарядов или электронов.
В противоположность этому при восстановлении хпроисходит уменьшение положительного заряда катиона или увеличение отрицательного заряда аниона. Например, о предыдущей реакции можно сказать, что наблюдается восстановление иона Н+ в атомный водород Н и что в обратном направлении реакции происходит восстановление иона Fe+++ в ион Fe++. Таким образом, восстановление сводится к увеличению количества электронов.
Однако, когда речь идет об окислении органических молекул, термин «окисление» сохраняет свой смысл превращения одной молекулы в другую или совокупность других, более богатых кислородом или менее богатых водородом. Восстановление же представляет собой обратный процесс, например окисление спирта СН3—СН2ОН в альдегид СН3—СНО, затем в уксусную кислоту СН3—СООН:
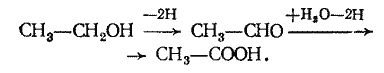
Процессы окисления органических молекул в клетке, которые постоянно встречаются в биологической химии и в микробиологии, происходят чаще всего путем дегидрирования. Они сочетаются с процессами восстановления и составляют окислительно-восстановительные процессы, например окисление при спиртовом брожении между глицериновым и уксусным альдегидом, катализируемое кодегидразой и ведущее к спирту:

Здесь речь идет о необратимом окислительно-восстановительном процессе, который, однако, может стать обратимым в присутствии катализатора, как будет показано ниже. Примером окисления-восстановления посредством обмена электронов и обратимого даже в отсутствие какого-либо катализатора является равновесие
Fe+++ + Cu+ Fe++ + Cu++.
Оно является суммой двух элементарных реакций, которые поставляет электрон
Fe++++e Fe++ и Cu+ Cu++ + е.
Такие элементарные обратимые реакции составляют окислительно-восстановительные системы или редокс-системы.
Они представляют непосредственный интерес для энологии. Действительно, с одной стороны, как было показано, ионы Fe++ и Cu+ автоокисляемы, т. е. они окисляются непосредственно, без катализатора, растворенным молекулярным кислородом, и окисленные формы могут повторно окислять другие вещества, следовательно, эти системы составляют катализаторы окисления. С другой стороны, они являются возбудителями помутнений, которые всегда опасны с точки зрения практики виноделия, и именно это обстоятельство тесно связано с их свойством переходить от одной валентности к другой.
Общий вид ионизированной окислительно-восстановительной системы, т. е. образуемой в растворе ионами, заряженными положительно или отрицательно, можно выразить так:
Red = Ох + е (или ne).
Общий вид органической окислительно-восстановительной системы, в которой переход компонента, восстановленного в окисленный, происходит путем освобождения водорода, а не электронов:
Red * Ох + Н2.
Здесь Red и Ох представляют молекулы, не имеющие электрических зарядов. Но в присутствии катализатора, например, одной из выше показанных окислительно-восстановительных систем или некоторых ферментов клетки Н,2 находится в равновесии со своими ионами и составляет окислительно-восстановительную систему первого типа
Н2 = 2Н+ + 2е,
откуда при суммировании двух реакций получаем равновесие
Red = Ox + 2H+ + 2e.
Таким образом, приходим к виду, аналогичному виду ионизированных систем, выделяющих электроны одновременно с обменом водорода. Следовательно, эти системы, как и предыдущие, электроактивны.
Нельзя определить абсолютный потенциал системы; можно лишь измерить разность потенциалов между двумя окислительно-восстановительными системами:
Red1 + Ох2 = Red2 + Ox1.
На этом принципе основаны определение и измерение окислительно-восстановительного потенциала такого раствора, как вино.
Классификация окислительно-восстановительных систем
Для того чтобы лучше рассмотреть окислительно-восстановительные системы вина и понять их роль, целесообразно воспользоваться классификацией Вурмсера, которая подразделяет их на три группы:
1) вещества непосредственно электроактивные, которые в растворе, даже одни, прямо обмениваются электронами с инертным электродом из платины, принимающим вполне определенный потенциал. Эти изолированные вещества составляют редокс-системы.
К ним относятся: а) ионы тяжелых металлов, составляющих системы Cu++/Cu+ и Fe++/Fe+++; б) многие красители, так называемые красители окисления-восстановления, используемые для колориметрического определения окислительно-восстановительного потенциала; в) рибофлавин, или витамин Вг, и дегидрогеназы, в которые он входит (желтый фермент), участвуя в клеточном дыхании в винограде или в дрожжах в аэробиозе. Это — автоокисляемые системы, т. е. в присутствии кислорода они принимают окисленную форму. Для их окисления кислородом не требуется катализатора;
2) вещества, обладающие слабой электроактивностью, которые не реагируют или реагируют слабо на платиновый электрод и самостоятельно не обеспечивают условий для равновесия, но становятся электроактивными, когда они находятся в растворе в присутствии веществ первой группы в очень слабых концентрациях и дают в этом случае определенный потенциал. Вещества второй группы реагируют с первыми, которые катализируют их окислительно-восстановительное превращение и делают необратимые системы обратимыми. Следовательно, красители окисления-восстановления позволяют исследовать вещества этой группы, определять для них нормальный потенциал и классифицировать их. Точно так же присутствие в вине ионов железа и меди делает электроактивными системы, которые, будучи изолированными, не являются окислительно-восстановительными системами.
К ним относятся: а) вещества с энольной функцией с двойной связью (—СОН = СОН—), в равновесии с дикетоновой функцией (—СО—СО—), например витамин С, или аскорбиновая, кислота, редуктоны, дигидрдксималеи-новая кислота; б) цитохромы, которые играют основную роль в клеточном дыхании как у растений, так и у животных;
3) электроактивные вещества в присутствии диастаз. Их дегидрирование катализируется дегидрогеназами, роль которых состоит в обеспечении переноса водорода из одной молекулы в другую. В целом этим системам придают электроактивность, которой они потенциально обладают, добавляя в среду катализаторы, обеспечивающие окислительно-восстановительные превращения; тогда они создают условия для окислительно-восстановительного равновесия и определенного потенциала.
Это системы молочная кислота — пировиноградная кислота в присутствии автолизата молочных бактерий, которые приводят в окислительно-восстановительное равновесие СН3— СНОН—СООН и СН3—СО—СООН — систему, участвующую в молочнокислом брожении; этанол — этаналь, которая соответствует переходу альдегида в спирт в процессе спиртового брожения, или же система бутандиол — ацетоин. Последние системы не имеют значения для самого вина, хотя и можно предположить, что вино может содержать дегидразы в отсутствие микробиальных клеток, но они имеют значение для спиртового или молочнокислого брожения, а также для готового вина, содержащего живые клетки. Они объясняют, например, восстановление этаналя в присутствии дрожжей или бактерий — факт, известный с давних пор.
Для всех этих окисляющих или восстанавливающих веществ можно определить окислительно-восстановительный потенциал, нормальный или возможный, для которого система наполовину окислена и наполовину восстановлена. Это позволяет классифицировать их в порядке окисляющей или восстанавливающей силы. Можно также заранее предвидеть, в какой форме (окисленной или восстановленной) находится данная система в растворе с известным окислительно-восстановительным потенциалом; предсказать изменения содержания растворенного кислорода; определить вещества, которые окисляются или восстанавливаются первыми. Этот вопрос достаточно освещен в разделе «Понятие об окислительно-восстановительном потенциале».