Существование электрического заряда частиц констатируют, пропуская через коллоидный раствор постоянный электрический ток.

Рис. 11.6. Электрофорез (частицы заряжены положительным электричеством). Выше коллоидного раствора находится чистый растворитель.
Частицы переносятся к одному или другому электроду. При этом, если перемещение наблюдается простым глазом, то речь идет о помутнении; или же оно определяется химическим количественным анализом коллоидного вещества, находящегося около каждого электрода. Это — явление электрофореза (рис. 11.6). Если частицы перемещаются к аноду, они заряжены отрицательно; в этих случаях говорят, что коллоид электроотрицательный, и наоборот. Эти понятия применяются к суспензиям и к гидрофобным коллоидам. Так, коллоидный: краситель, фосфат железа, железисто-синеродистое железо, сульфат меди, диатомит, каолин, бентонит заряжены отрицательно даже в такой кислой среде, как вино (pH 3), где значительно преобладают ионы Н+ над ионами ОН-; и наоборот, целлюлоза, гидроокись железа заряжены положительно.
Для объяснения заряда частиц было предложено несколько теорий. По физической теории электрический заряд образуется в результате адсорбции на поверхности частиц ионов из раствора или анионов, сообщающих частице отрицательный заряд, или катионов, которые сообщают ей положительный заряд (рис. 11.7).
Во всех случаях, когда осуществляется контакт между твердым телом и жидкостью, в зоне их соприкосновения возникают два электрических слоя с противоположными знаками, (двойной электрический слой). При этом один из них примыкает к твердому телу, которому он сообщает свой знак, другой же образуется тонким слоем жидкости, окружающим твердое тело, и обеспечивает нейтральность всего комплекса. Точнее, вокруг частицы или оболочки находится некоторый объем, нечто вроде «атмосферы», в которой преобладают ионы ( + ) или ионы (—), причем их избыток уменьшается по мере удаления от оболочки. В сущности, никакого двойного слоя нет, но наряду с ионами, фиксированными на такой оболочке, имеется как бы рассеянный слой — ионная атмосфера оболочки (рис 11.8). На некотором удалении ионы ( + ) и ионы (—) распределены равномерно в эквивалентной численности и более или менее перемешаны с ионами раствора, наиболее удаленными от ионной атмосферы, что на рисунке не показано.
Частицы, взвешенные в чистой воде при pH 7, которая включает катионы Н+ и анионы ОН- в эквивалентных количествах, обычно покрыты слоем ионов. ОН-, который сообщает им отрицательный заряд; в совокупности они
представляют собой крупный радикал кислого характера, насыщенный внешними ионами Н+. Частицы, взвешенные в вине, которое содержит немного больше ионов Н+, чем ионов ОН~ (pH 3), имеют тенденцию фиксировать меньше ионов ОН-, чем в чистой воде, или даже фиксировать ионы Н+ и принимать положительный заряд; фиксации ионов Н+ способствует их относительно высокая концентрация.
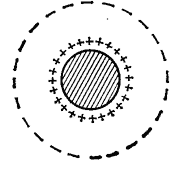
Рис. 11.7. Схематическое изображение двойного слоя вокруг электроположительной частицы.

Рис. 11.8. Ионная атмосфера.
Между высокими pH, которые сообщают отрицательный заряд, и низкими pH, сообщающими положительный заряд, существует некоторый pH, так называемая изоэлектрическая точка, где заряд, равен О. Изоэлектрический pH обычно не совпадает с нейтральностью (pH 7).. Ионы Н+ и ОН- не единственные, которые могут фиксироваться коллоидными частицами, хотя их действие обычна бывает преобладающим. Следовательно, различные анионы и катионы раствора в большей или меньшей мере фиксированы: поливалентные ионы могут менять знак, сообщенный ионами Н+ или ОН-. Для получения стабильности частица должна фиксировать положительные или отрицательные ионы, следовательно, жидкость должна содержать некоторое количество электролитов. Если из раствора удалить посредством диализа все электролиты, произойдет флокуляция.
Таким образом, эта теория включает ионную адсорбцию. Фиксируются наиболее адсорбируемые ионы и те, которые содержатся в наибольшей пропорции. Но частицы часто состоят из микрокристаллов и случается, что просто один из ионов, образующих эти микрокристаллы, оказывается лишним. Он входит в микрокристаллическую решетку и находится на поверхности микрокристалла в точно определенном положении. Не все микрокристаллы обязательно нейтральные, и лишний ион дает микрокристаллу свой собственный знак. Результат тот же, как и при ионной адсорбции.
Разработаны и другие концепции о составе и структуре гидрофобных коллоидов. Их свойства легче объяснить, если допустить, что атомы образуют в них правильную кристаллическую решетку, прерываемую нарушениями структуры, которые представляют собой точки связи между молекулой и внешней средой и точки воздействия реактивов. Именно эти разрывы в некоторых случаях в большей степени ответственны за растворимость и стабильность коллоидов, чем поверхностные явления и ионная адсорбция.
Согласно химической теории заряд имеет химическую природу: коллоидные частицы ведут себя как молекулы электролитов. Так же как в растворе, молекула NaCl разлагается на две части: один или несколько простых ионов обычного размера и крупный ион значитательно большего размера, который бывает анионом или катионом.
Например, частица золя сульфата меди отрицательного коллоида состоит из молекулы сероводорода, ассоциированной с некоторым числом молекул сульфата меди и, следовательно, может быть записана как (CuS)n-H2S. Эта частица разлагается в жидкости, как молекула, давая два иона Н+ и один крупный комплексный ион, заряженный отрицательно, т. е. (CuS)n*S__. Также крупный комплексный ион гидроокиси железа (положительный коллоид) будет, например, в присутствии ионов Cl- иметь вид (Fe(OH3)nFe+++. Возрастание размера частиц, связанное с увеличением числа п и ведущее к флокуляции, видимо, обусловлено химическими реакциями. Эти реакции касаются в первом случае только радикала H2S, составляющего активную часть частицы, или же во втором случае оно ведет к удалению посредством диализа электролитов из раствора, вызывая отделение ионов Fe+++ от частицы и увеличение п. Заряд здесь обязан не «ионной адсорбции, а ионизации активной молекулы или «поверхностной ионизации».

