ГЛАВА III
МИКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ МИКРООРГАНИЗМОВ
Микроскопическое исследование применяется в микробиологической практике для установления формы, размеров, способа размножения и подвижности микробов.
ПРИГОТОВЛЕНИЕ ПРЕПАРАТОВ
В микроскопе можно рассматривать только прозрачные предметы. Если предмет непрозрачен, то с него делают тонкие срезы. Препарат готовят на предметном стекле, представляющем собой стеклянную пластинку размером 76 на 25 мм. Предметные стёкла можно нарезать из тонкого оконного стекла, отшлифовав края наждаком. Для очистки новые стёкла кипятят 10—20 минут в мыльной воде или в 1%-ном растворе соды. Затем ополаскивают их водой, протирают слабой соляной кислотой и снова промывают водой. Стёкла, бывшие в употреблении, выдерживают два часа в смеси из 50 г двухромовокислого калия, 100 мл серной кислоты и 1000 мл воды. После промывки водой их обрабатывают так же, как новые стёкла. Все стёкла хранят в сухой закрытой банке или в 95° спирте.
Препарат, помещённый на предметное стекло, покрывают сверху покровным стеклом. Это тонкая стеклянная пластинка размером 18 на 18 мм или 20 на 20 мм. Эти стёкла покупают готовыми. Для приготовления препарата на середину предметного стекла наносят каплю воды и в неё вносят исследуемый предмет. Если исследуемая среда жидкая, можно предварительно воду не наносить.
Для прижизненной окраски микробов вместо воды наносят каплю реактива Люголя (раствор йода в йодистом калии) или метиленовой синьки. Препарат покрывают сверху покровным стеклом. Чтобы избежать попадания пузырьков воздуха, покровное стекло располагают наклонно у края капли, а затем опускают. Размер капли должен быть таким, чтобы она не выступала за края покровного стекла. Если капля получилась больше, то лишнюю жидкость убирают полоской фильтровальной бумаги. Жидкость наносят с помощью капельной пипетки, а твёрдые объекты — платиновой или другой металлической петлёй или иглой.
ИССЛЕДОВАНИЕ МИКРОБОВ В ЖИВОМ ВИДЕ
Приготовленный, как сказано выше, препарат может быть использован для изучения бактерий в живом состоянии. В таком препарате можно рассмотреть форму, размеры, а также наличие подвижности у бактерий. Однако возникающие в препарате токи жидкости могут помешать установлению подвижности. При этом следует помнить, что токи эти движутся только в одном направлении, а бактерии—в разные стороны.
Для лучшего выяснения подвижности бактерий следует пользоваться висячей каплей. Этим способом можно изучать также размножение, прорастание спор и другие вопросы.
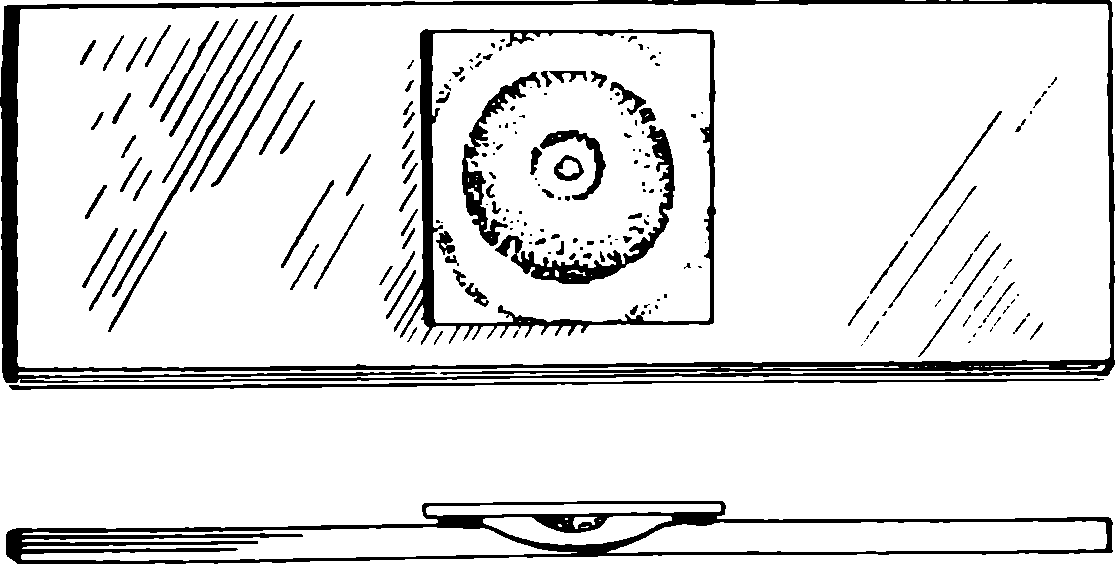
Рис. 51. Правильно приготовленная висячая капля (разрез и вид сверху).

Для приготовления висячей капли используют специальные предметные стёкла с углублениями в середине. Края выемки предметного стекла и края покровного стекла смазывают вазелином. На середину покровного стекла наносят маленькую капельку исследуемой среды и стекло переворачивают над углублением. Таким образом создаётся влажная камера, в которой находится висящая капля с микроорганизмами. При наличии в исследуемой среде питательных веществ развитие микробов продолжается; под микроскопом можно следить за их поведением. Для установления подвижности бактерий следует найти край капли, так как аэробные формы лучше обнаруживают подвижность при доступе воздуха (для этого хорошо изготовить препарат сенной палочки). Для исследования бактерий в живом виде удобно пользоваться бактериями гнилого гороха и сенной палочки. Получить эти культуры можно следующими путями.
Получение бактерий гнилого гороха.
В банку насыпают горох, заливают водой и помещают в термостат при температуре 25—30° на 2—3 дня. В приготовленном препарате, кроме гнилостных бактерий (кокки), можно увидеть и крупные палочки маслянокислых бактерий, часто со спорами на конце (барабанные палочки).
Получение сенной палочки.
Мелко изрезанное сено помещают в колбу на одну треть её объёма, добавляют немного порошка мела для нейтрализации и наливают на 2/3 объема водой. Закрывают ватной пробкой и кипятят в течение 10 минут для уничтожения вегетативных клеток. Дают остыть; затем помещают в термостат при температуре 25—30° на 1—2 суток. Оставшиеся живыми споры сенной палочки образуют на поверхности настоя плёнку. При микроскопировании можно увидеть молодые подвижные палочки и неподвижные клетки с блестящими спорами сенной палочки.
ФИКСАЦИЯ И ОКРАШИВАНИЕ МИКРОБОВ
Способы окраски
Для изучения бактерий часто приходится пользоваться окрашенными препаратами. Изготавливают их следующим образом. На предметное стекло наносят небольшую каплю исследуемой жидкости и при помощи платиновой петли размазывают её тонким слоем, который почти тут же высыхает. Для того чтобы бактерии лучше воспринимали краски, их нужно предварительно умертвить (фиксировать). Это можно сделать нагреванием, проведя три раза нижней стороной стекла над пламенем горелки. Этот приём не пригоден для изучения строения бактериальной клетки. В этом случае надо пользоваться химическими фиксаторами. К ним относятся: 1. Этиловый спирт (препарат смачивают несколькими каплями этилового спирта и выдерживают 5 минут). 2. Смесь этилового спирта и эфира в равных объёмах (смачивают несколькими каплями и дают испариться). 3. Ацетон (обливают препарат несколькими каплями ацетона и выдерживают 5 минут). 4. Формалин (фиксацию производят, держа стекло мазком вниз над парами формалина). 5. Осмиевая кислота (1—2%-ный раствор осмиевой кислоты быстро фиксирует бактерии, не изменяя их строения). Цель фиксации — не только убить бактерии, но и приклеить мазок к стеклу.
После фиксации приступают к окрашиванию. Если фиксация химическая, то предварительно смывают фиксатор. На мазок накладывают кусочек фильтровальной бумаги, на которую наливают краску. Различают простую н сложную окраску. Окраска одним красителем называется простой, а несколькими — сложной. Продолжительность окрашивания зависит от применяемого красителя и составляет в среднем 2—3 минуты. Затем лишнюю краску смывают струёй воды и препарат высушивают между листками фильтровальной бумаги. Окрашенные препараты можно рассматривать как с каплей воды, прикрытые покровным стеклом, так и сухими, с каплем кедрового масла при работе с иммерсионным объективом.
Для окраски бактерий применяются следующие растворы.
- Метиленовая синь. Сначала готовят насыщенный спиртовый раствор, для чего растворяют 3 г краски в 100 мл 96° спирта и настаивают несколько дней при ежедневном взбалтывании. Затем 1мл этого раствора разбавляют в 10 или 40 мл воды. Метиленовая синь окрашивает бактерии в синий цвет.
- Щелочная метиленовая синь. К 100 мл воды добавляют 30 мл насыщенного спиртового раствора метиленовой сини (см. выше) и 1мл 1 %-ного раствора едкого калия. Эта краска окрашивает не одинаково разные части клеток: протоплазму в синий, слизь в розовый, а волютиновые зёрна в фиолетовый цвет. Приготовленная краска должна некоторое время постоять, т. к. при хранении её красящая способность усиливается.
- Метилвиолет (неочищенный препарат этой краски называют генцианвиолетом). Приготавливается так же, как и метиленовая синь. Окрашивает в фиолетовый цвет.
- Фуксин основной. Готовится насыщенный спиртовый раствор из Юг фуксина и 100мл 96э спирта. Затем 10—20мл этого раствора разбавляют 100 мл воды. Окрашивает очень быстро (40—60 секунд) в красный цвет. Недостатком является грязный фон препарата, так как окрашиваются белковые вещества.
- Карболовый фуксин Циля. К 10 мл насыщенного спиртового раствора фуксина прибавляют 5 г фенола и постепенно разбавляют 100 мл дистиллированной воды. Через 24 часа краску фильтруют и хранят в склянке с притёртой пробкой.
- Карболовый фуксин Пфейффера. Его готовят из карболового фуксина Циля, разбавленного в 10 раз дистиллированной водой. Краску готовят каждый раз перед употреблением п фильтруют.
- Карболовый эритрозин. Он применяется для окраски бактерий, находящихся на небелковых материалах. Приготовляется из 1г эритрозина, 5 г фенола и 100 мл дистиллированной воды.
- Гематоксилин. Применяется для окраски ядерного вещества. 2 грамма гематоксилина растворяют в 12 мл абсолютного спирта и смешивают с 200 мл концентрированного раствора железо-аммиачных квасцов. После 3—4 дней фильтруют, добавляют 50 г глицерина, 50 г метилового спирта и выдерживают до получения тёмной окраски. Затем снова фильтруют и разбавляют водой по мере надобности. При необходимости быстрого окрашивания используют крепкие растворы.
- Судан III. Применяется для окраски жира. В жире он растворяется, окрашивая его в красный цвет. Для приготовления красителя 0,1 г судана III растворяют в 200 мл 90° спирта или в концентрированной молочной кислоте.
Окраска по Граму
Отношение бактерий к окраске по Граму имеет очень большое практическое значение для распознавания бактерий, т. е. для их диагностики. Все бактерии можно разделить на две группы — грамположительные и грамотрицательные. Грамположительные бактерии окрашиваются по Граму, а грамотрицательные не окрашиваются. Окрашивание по Граму объясняется, по последним данным, присутствием в клетках бактерий магниевой соли риоонуклеиновой кислоты, дающей с применяемой краской (генцианвиолетом) прочное соединение, не растворимое в спирте. Чёткие результаты дают молодые культуры, 1—2-суточные. Реактивы: 1. Карболовый генцианвиолет. Один грамм краски растворяют в 10 мл спирта и добавляют 100 мл 5%-ного раствора фенола. 2. Раствор Люголя. Один грамм кристаллического йода растворяют в концентрированном растворе йодистого калия (2 г в 5 мл воды) и добавляют воду до 300 мл. 3. Фуксин основной (стр. 245).
При окрашивании поступают следующим образом. Мазок высушивают, фиксируют на пламени горелки, покрывают фильтровальной бумагой, на которую пипеткой наносят генцианвиолет и подогревают до появления пара. Фильтровальную бумагу удаляют, препарат промывают и наносят на него раствор йода (Люголя). Через 1—2 минуты препарат снова промывают водой и погружают его в 95° спирт на 30—60 секунд. Это очень ответственный момент, так как при недодержке клетки не успевают обесцветиться и окажу тся грамположительными и, наоборот, при слишком длительной обработке спиртом все они обесцветятся, т. е. окажутся грамотрицательными. И в этом, и в другом случае результат будет ошибочным. Клетки, окрашенные по Граму, будут тёмно-фиолетовыми, а грамотрицательные останутся бесцветными. Их можно дополнительно окрасить фуксином. При исследовании отношения бактерий к окраске по Граму рекомендуется рядом сделать для сравнения мазки (контрольные) с заведомо известными микробами — грамположительными (сенная палочка, дрожжи) и грамотрицательными (уксуснокислые бактерии).
В) Окраска жгутиков
Подвижность бактерий чаще всего объясняется наличием жгутиков, которые располагаются на поверхности клетки — либо на всей поверхности (перитрихиально), либо на одном конце (полярно). Изучение жгутиков затрудняется тем, что это очень тонкие образования (не толще 0,05 микрона) и в оптическом микроскопе не могут быть рассмотрены. Поэтому прибегают к специальной окраске препарата, с предварительным протравливанием, причём жгутики утолщаются накладывающейся на них протравой.
Особое внимание надо обратить на приготовление препарата. В качестве материала следует пользоваться очень молодыми культурами (12—24 часа). Хорошим материалом для изучения жгутиков может служить плёнка, покрывающая воду в аквариумах, из застоявшейся грязной воды и т. д.
Стекло, на котором готовят препарат, должно быть совершенно чистым, для чего предварительно его обрабатывают хромовой смесью. Некоторые авторы рекомендуют делать препарат на покровном стекле, также предварительно обработанном. Перед нанесением на стекло бактерии выдерживают 30— 60 минут в пробирке со стерильной водой. Затем делают на стекле тонкий мазок, высушивают его, фиксируют нагреванием или 2%-ной осмиевой кислотой.
Окраску проводят одним из следующих методов.
- Метод Леффлера. Препарат обрабатывают протравой, состоящей из 12 г танина, 48 мл воды, 30 мл насыщенного раствора железного купороса (FeSО4) и 6 мл насыщенного раствора фуксина в 95° спирте. Протраву следует готовить на 3—4 дня раньше и держать в склянке с притёртой пробкой. Перед употреблением раствор фильтруют. Старая протрава лучше. Протраву наливают на мазок так, чтобы весь препарат находился в течение 3—5 минут под жидкостью. Некоторые авторы рекомендуют нагревать препарат до появления пара.
Если препарат готовят на покровном стекле, то протравливание производят на часовом стекле. Затем препарат тщательно промывают водой и окрашивают карболовым фуксином Циля, подогретым в течение 2—3 минут до образования пара. Препарат ещё раз промывают и затем микроскопируют его. Этот способ не всегда даёт хорошие результаты.
- Метод серебрения. Мазок фиксируют 2%-ной осмиевой кислотой, погружают на несколько секунд в 0,25—0,5%-ный раствор азотнокислового серебра (в воде или в спирте). Затем переносят на несколько секунд в раствор из 5 г галловой кислоты, 3 г танина, 10 г уксуснокислого безводного натрия и 350 мл дистиллированной воды.
Снова переносят препарат в первый раствор и держат в нём до почернения. Промывают водой и микроскопируют. Жгутики окрашиваются в чёрный цвет.
- Метод Плиммера и Пенеса. Высушенный мазок покрывают фильтровальной бумагой и обливают краской, состоящей из 10 г танина, 10 г хлористого цинка, 18 г хлористого алюминия, 1,5 г фуксина в порошке, 40 мл 60° спирта. Сухие вещества растирают в ступке и к ним постепенно добавляют спирт.
Перед употреблением краску разбавляют пятью частями воды и фильтруют. После 1,5—2 минут выдерживания в краске препарат промывают водой и докрашивают 1—2 минуты карболовым фуксином Циля.
Окраска спор
Споры покрыты толстой оболочкой, которая труднее воспринимает краску и затем труднее отдаёт её, чем вегетативные клетки. Окраска спор основана на том, что препарат сильно красят одной краской, затем частично обесцвечивают протоплазму и перекрашивают её другой краской. При этом поступают следующим образом. Высушенный и фиксированный нагреванием мазок покрывают полоской фильтровальной бумаги, обливают карболовым фуксином Циля и нагревают до появления пара, не доводя до кипения. По мере испарения краски доливают свежую.
Окрашивание длится 2—3 минуты. Затем краску смывают, препарат промывают водой и помещают для обесцвечивания в 1%-ный раствор серной, соляной или уксусной кислоты, или в спирт, разбавленный в три раза водой. Обесцвечивание длится от нескольких секунд до нескольких минут, в зависимости от особенностей препарата, чаще всего 30 секунд.
Обесцвеченный препарат промывают водой и дополнительно окрашивают в течение 1—2 минут метиленовой синью. При этом споры окрашиваются в красный цвет, а клетки бактерий — в синий. Хорошим материалом для окраски спор является сенная палочка и маслянокислые бактерии.
Окраска капсул
Некоторые виды бактерий вырабатывают слизь, образующую вокруг каждой клетки слизистую капсулу. Эта капсула может быть замечена и в неокрашенном препарате благодаря удалению клеток друг от друга. Её можно видеть хорошо, применяя контрастную окраску. Хорошим материалом для изучения капсул является культура азотобактера, которую можно получить из почвы, удобренной азотобактерином. На предметное стекло износят наполовину разбавленную водой каплю карболового фуксина Циля, к которой примешивают каплю изучаемой культуры; через 2—3 минуты туда же добавляют каплю чёрной туши, перемешивают, размазывают по стеклу и высушивают. При микроскопировании на чёрном фоне, создаваемом тушью, видны окрашенные в красный цвет клетки бактерий, окружённые неокрашенной капсулой.
При другом способе препарат окрашивают кипящим раствором метиленовой сини (1 часть краски, 10 частей спирта, 100 частей воды), промывают водой и дополнительно окрашивают в течение 5 секунд раствором фуксина (1 часть краски, 10 частей спирта, 100 частей воды). Клетки бактерий окрашиваются в синий, а капсулы в розовый цвет.
д) Окраска включений, содержащихся в протоплазме
В результате жизнедеятельности клетки в её протоплазме откладываются различные вещества — включения, выполняющие роль запасных питательных веществ. К таким включениям относятся: волютин, гранулёза, гликоген, жир и т. д. Волютин относится к нуклеопротеидам и содержит в себе фосфорную кислоту. В протоплазме клеток он откладывается в виде мелких зёрен. Метиленовой синью волютин окрашивается в красный или фиолетовый цвет.
Для обнаружения волютина, по Омелянскому, поступают следующим образом. Фиксированный нагреванием препарат окрашивают в течение 30 секунд карболовым фуксином Циля, промывают водой, обесцвечивают 1%-ной серной кислотой в течение 20—30 секунд, снова промывают водой и дополнительно окрашивают слабым раствором метиленовой сини (1:40) в течение 15—20 секунд. Зёрна волютина окрашиваются в красный цвет, а протоплазма — в синий. Для накопления у микробов волютина следует добавлять к среде фосфорнокислые соединения.
Гликоген (животный крахмал).
Вещество, близкое к крахмалу. Откладывается у дрожжей и некоторых бактерий (сенная палочка). Реактивом на гликоген служит раствор Люголя (йод в йодистом калии), от которого гликоген окрашивается в красно-бурый цвет, а протоплазма — в жёлтый цвет. Лучшее окрашивание получается, если применять раствор из 7 г йода и 20 г йодистого калия в 100 мл воды. Поскольку жир даёт с этим реактивом такую же окраску, как и крахмал, рекомендуется предварительно обезжирить клетки спиртом и эфиром.
Для обогащения дрожжей гликогеном их выращивают сначала на солодовой среде, затем сливают эту среду с дрожжевого осадка и добавляют 20-процентную сахарозу. Через сутки клетки дрожжей будут переполнены гликогеном. Реакция на гликоген имеет большое значение при изучении физиологического состояния дрожжей для микробиологического контроля винодельческого производства.
Гранулёза.
Является полисахаридом, близким к крахмалу. Она образуется у многих бактерий перед спорообразованием, в частности, у маслянокислых бактерий. Для обнаружения гранулёзы пользуются раствором йода в йодистом калии (1 г йода, 2г йодистого калия на 100 мл воды). При этом гранулёза окрашивается в тёмно-синий цвет.
Жир.
Откладывается в клетках многих микроорганизмов. Реактивом на жир является Судан III, от которого капелька жира окрашивается в красный цвет, тогда как протоплазма остаётся бесцветной. Лучшие результаты получаются при контрастной окраске бактерий. С этой целью к капле исследуемого материала на предметном стекле добавляют каплю формалина (40% формальдегида) и оставляют на 5 минут. Затем добавляют каплю раствора метиленовой сини 1:40 и после 10 минут вносят каплю раствора Судана III. При микроскопировании можно видеть клетки, окрашенные в синий цвет, а капли жира в них — в розовый или оранжевый. Для накопления жира микроорганизмы следует выращивать на среде, богатой углеводами (мясопептонный агар с добавлением 2% глюкозы).
е) Окраска живых и мёртвых бактерий и дрожжей
Бактерии.
Мазок легко фиксируют на пламени так, чтобы не убить бактерии, но, чтобы он пристал к стеклу и при окраске не смывался. На пять минут накрывают мазок раствором щелочной метиленовой сини, промывают дистиллированной водой и окрашивают на 5—10 секунд карболовым фуксином Пфейффера, затем опять промывают водой. Живые клетки окрашиваются в синий цвет, а мёртвые в розовый или фиолетовый. Живые споры не окрашиваются; мёртвые окрашиваются в синий цвет.
Дрожжи.
Установить наличие мёртвых дрожжевых клеток в исследуемой среде можно, применяя окрашивание слабым раствором метиленовой сини — 0,01%. Препарат готовят следующим образом. На предметное стекло наносят каплю исследуемой жидкости, добавляют одну-две капли метиленовой сини, тщательно перемешивают, покрывают покровным стеклом и через пять минут микроскопируют. Живые клетки не пропускают краски и остаются бесцветными, а мёртвые окрашиваются в синий цвет.
Более наглядные результаты получаются при контрастной окраске. В качестве красителя применяют смесь равных объёмов метиленовой сини и нейтральрота (1 10000). Краску следует употреблять только свежую. Препарат готовят, смешивая на предметном стекле немного краски и исследуемого материала. Через 15 минут микроскопируют. Мёртвые клетки окрашиваются в тёмно-синий цвет, а живые — в красный.
ИЗМЕРЕНИЕ ВЕЛИЧИНЫ МИКРОБОВ
Размер клетки микроба является непостоянной величиной и зависит от ряда факторов — температуры, влажности, аэрации, концентрации солей, продуктов обмена веществ, возраста культуры. Однако средние величины для каждого вида микроба довольно постоянны. При посеве на свежую питательную среду в первые 2—3 часа размеры клеток бактерий увеличиваются. В последующие часы появляются более мелкие клетки, образующиеся в результате размножения. По мере истощения питательных веществ мелкие клетки исчезают, т. к. размножение прекращается. Наиболее характерным для каждого вида является размер клеток 12—18-часовой культуры, когда они более или менее однородны. Поэтому для измерения пользуются чаще всего 18—20-часовой культурой.
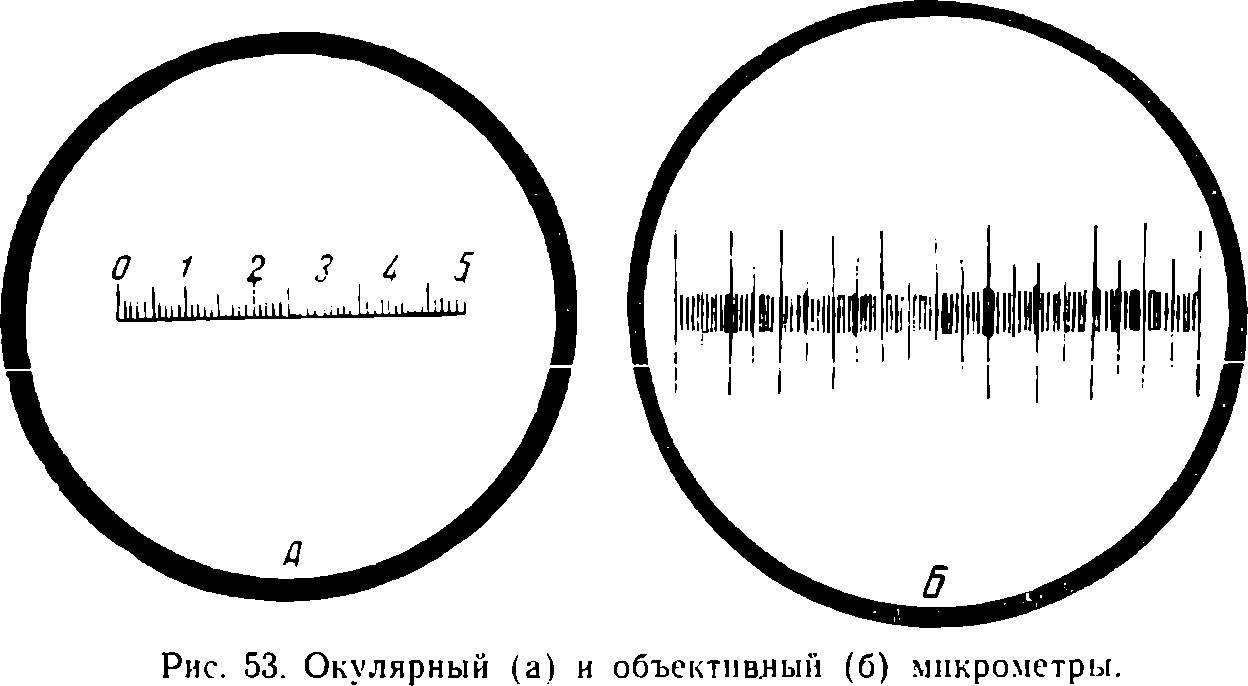
Определение размеров клеток производят при помощи окулярного микрометра. Последний представляет собою круглую стеклянную пластинку с нанесённой на ней шкалой. Эта пластинка вставляется в окуляр; можно применять и специальный измерительный окуляр (см. стр. 244).
Цена деления окуляра определяется в каждом отдельном случае при помощи объективного микрометра — стеклянной пластинки, на которой 1 мм разделён на 100 частей. Каждое деление объективного микрометра соответствует 0,01 мм или 10 микронам.
Объективный микрометр помещают на столик микроскопа и определяют, какому количеству делений окулярмикрометра соответствует одно или несколько делений объектив-микрометра. Например, пять делений окулярного микрометра соответствуют двум делениям объективного микрометра, т. е. 20 микронам. Следовательно, значение одного деления окулярного микрометра равно 20 : 5 = 4 микронам. Определив затем, скольким делениям окулярного микрометра отвечает измеряемая нами клетка микроба, умножаем эту величину на 4 и получаем размер клетки в микронах.

