При биологической характеристике вновь изучаемой группы фагов непременным условием является определение чувствительности к ряду физических и химических факторов (повышенная температура, УФ-облучение, концентрированный раствор мочевины, цитрат натрия и др.). Изучение этих свойств необходимо как в целях таксономии фагов, так и в целях разделения их с соответствующими бактериями, что может оказаться необходимым как в лабораторной практике, так и в производстве.
Термостабильность фагов .Сведения о термоустойчивости фагов молочнокислых бактерий чрезвычайно противоречивы. Некоторые авторы отмечают высокую чувствительность фагов к нагреванию [105, 111, 153]: заметная и полная инактивация наступала при 55-65°С. Однако есть сведения о высокой термоустойчивости фагов [9, 59, 132, 185], выдерживающих нагревание при 95-100°С в течение 5-10 мин. Такое разнообразие сведений связано, очевидно, с разнообразием методик и сред, применяемых при исследовании термочувствительности, хотя большую роль играет и природа фага.
Процесс термоинактивации затрагивает, в основном, белковый компонент фаговой частицы и является результатом денатурации белка. Инактивация фагов сопровождается
выделением в раствор нуклеиновой кислоты 12].
Электронномикроскопический контроль тепловой инактивации фагов доказывает, что она связана с дезинтеграцией фаговых частиц, утратой их нормальной морфологии [73а].
При изучении влияния температурного фактора на фаги Lact. plantarum нами использовались следующие температурные режимы: 45-46°С; 56-58; 65-70°С; 80°С. Константа скорости инактивации при 46°С составила для фагов Lp 20/ 5, Lp 7/6 и Lp 16/28 величины 0,133; 0,093; 0,162 мин/1 соответственно, что указывает на низкую термостабильность этих фагов.
При 56-58°С фаги Lp 20/5 и Lp 16/28 инактивировались полностью за 10-15 мин. (табл.5.9). Более стабильным при этой температуре оказался фаг Lp 7/6, который ещё через 40-60 мин. сохранял небольшое количество активных частиц. Константа скорости инактивации его составила 0,385- 0,655 мин/1, для фага Lp 20/5 она была равна 1,77 мин.'1.
При температуре 65-70°С инактивация всех трёх фагов наступала в течение 3-5 мин., при 80°С уже через 1 мин. фаговые корпускулы не обнаруживались.
Таким образом, изученные нами фаги весьма чувствительны к действию температур. Наиболее термостабильным оказался фаг Lp 7/6. Высокая чувствительность к нагреванию связана, очевидно, с происхождением фагов. Фаги, выделенные из природных источников и в условиях производства, оказываются значительно более устойчивыми.
Таблица 5.9
Термостабильность фагов лактобактерий
Режимы, °C | Время инактивации фагов, мин. | ||
Lp 20/5 | Lp7/6 | Lp 16/28 | |
45-46 | более 120 | более 120 | более 120 |
56-58 | 15 | более 60 | 10 |
65-70 | 3-5 | 5 | 5 |
80 | 1 | 1 | 1 |
Влияние цитрата натрия. Изучению отношения фагов к присутствию в среде цитрата натрия отводится существенное место в связи с тем, что данное вещество обладает фагостатическим действием, нарушая определённый этап взаимодействия фага с бактериальной клеткой, не вызывая инактивации свободного фага. Это влияние связывают со способностью цитрата инактивировать ионы кальция, необходимые для взаимодействия фага с клеткой [186]. Единственное сообщение о чувствительности фага МКБ к цитрату натрия имеется у Черри и Уотсона [105]. Бертран в 1933 г. первый высказал предположение, что чувствительность к цитрату может быть ценным таксономическим признаком [2].
Результаты изучения отношения фагов L. plantarum к присутствию в среде цитрата натрия представлены в таблице 5.10.
Все три фага мало отличались друг от друга по чувствительности к присутствию в среде данного агента и при содержании 2,5% цитрата натрия полностью утрачивали способность к формированию негативных колоний.
Высокая чувствительность к цитрату вполне согласуется с выраженной потребностью фагов L. plantarum в ионах кальция.
Влияние мочевины. Инактивирующее действие мочевины связывают с повреждением дистального конца отростка, приводящим к потере вирионом адсорбционной способности [13].
При изучения действия мочевины на фаги L. plantarum показана различная чувствительность их к данному агенту. Так, полная инактивация фага Lp 16/28 наступала в течение 3 минут (табл. 5.11), фагов Lp 20/5 и Lp 7/6 - в течение 10 мин. После 5-минутной экспозиции с мочевиной фаг Lp 20/5 снижал титр до 3,0 х 101, у фага Lp 7/6 сохранялась 3,4 х 103 корпускул при одинаковом исходном титре порядка 109. Константы скорости инактивации для фагов Lp 20/5, Lp 7/6 и Lp 16/28 составляли соответственно величины 13, 71; 12,65; 17,04 мин1.
Таблица 5.10
Влияние цитрата натрия на фаги лактобактерий
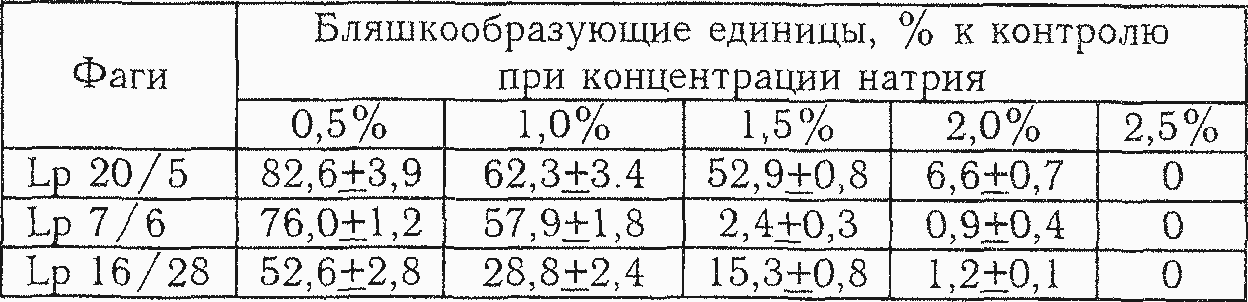
Таблица 5.11
Влияние мочевины на фаги L.plantarum
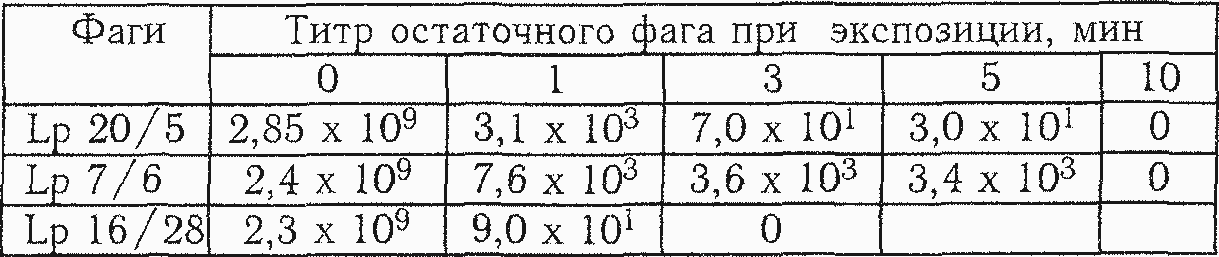
Полученные нами данные о влиянии концентрированных растворов мочевины являются первыми не только в отношении фагов L.plantarum, но и группы фагов молочнокислых бактерий в целом.
Ультрафиолетовая инактивация. Изученные нами фаги L. plantarum практически не различались по своей чувствительности к УФ-лучам. После 1 мин. облучения небольшое количество фага ещё удавалось обнаружить. Двух-трёх минутное облучение приводило к полной инактивации фаговых частиц.
Отмечена высокая чувствительность фагов молочнокислых стрептококков к УФ-облучению [9,153].
Выявлено влияние облучения на морфологию негативных колоний. Бляшки, образованные облученным фагом, сильно варьировали в размерах с преобладанием мелких колоний (фаг Lp 20/5) или были чрезвычайно мутными за счёт интенсивного вторичного роста (фаги Lp 16/28 и Lp 7/6). Резкое уменьшение размеров колоний можно объяснить задержкой размножения за счёт значительного увеличения латентного периода. Появление вторичного роста, очевидно связано со снижением способности облученных фагов к продуктивной инфекции.
Влияние осмотического шока. Инактивация фагов при быстром падении осмотического давления среды, связанная с различной проницаемостью белковых оболочек фагов, широко используется при биологической характеристике фагов. Проверка чувствительности исследуемых фагов Lact. plantarum к осмотическому шоку путём действия трёхмолярным раствором хлористого натрия показала их устойчивость к резкому изменению осмотического давления.
Изучение фотореактивации. При изучении способности фагов восстанавливать утраченную после УФ-облучения активность с помощью видимого света фотореактивация не была выявлена ни у одного из трёх фагов.
Таким образом, изучение биологии 3 умеренных фагов Lact. plantarum позволило выявить различия между ними по ряду свойств. Особенно чётко дифференцируется фаг Lp 7/6. Он отличается по деталям тонкого строения, по антигенным свойствам. Выявленные различия дают основания считать изученные нами фаги различными штаммами одного вида бактериальных вирусов.

