Глава 3. МЕТОДЫ ПРОГНОЗИРОВАНИЯ ПОМУТНЕНИЙ И ОПРЕДЕЛЕНИЕ СТАБИЛЬНОСТИ ВИН
В винодельческой практике необходимо иметь методы определения вина помутнения нестабильного вина, чтобы устанавливать пути борьбы с данным помутнением. По внешнему виду и дегустацией даже опытному виноделу не всегда можно установить причины образования мути или осадка. Кроме того, перед розливом в бутылки винодел должен быть уверен, что вино будет стабильно на протяжении гарантийного срока.
В настоящее время разработаны методы определения вида помутнения, а также тесты для определения стойкости вина к основным видам помутнений.
Все необработанные виноматериалы подвергают предварительным лабораторным исследованиям на склонность к различным видам помутнений по схемам, приведенным ниже. Технологические схемы и режимы обработки в производственных условиях назначает главный инженер-винодел предприятия совместно с заведующим лабораторией технохимического контроля на основании результатов предварительных лабораторных исследований.
Для предварительного исследования необработанных виноматериалов на склонность к различным видам помутнений отбирают среднюю пробу от однородной партии вина (кулажа) по правилам, предусмотренным действующим ГОСТом. В средней пробе определяют титруемую и летучую кислотность, рН, содержание общего и свободного SO, общего количества железа. Проба также должна быть охарактеризована органолептически.
Испытание виноматериалов и вин на склонность к микробиологическим помутнениям
При оценке микробиологического состояния виноматериалов по времени развития микроорганизмов проба отбирается с соблюдением правил стерильности.
Микробиологическая стойкость виноматериалов и вин оценивается двумя методами: по количеству клеток микроорганизмов в пробах и по времени развития их в отобранных образцах и в элективных питательных средах.
Предварительный метод ориентировочно-экспрессной оценки
Предварительный метод оценки основан на определении степени обсемененности виноматериалов микроорганизмами, развивающимися в них: дрожжами, молочнокислыми и уксуснокислыми бактериями. Общее число клеток микроорганизмов определяют микроскопированием отобранной пробы или микроскопированием после центрифугирования.
При микроскопировании с предварительным центрифугированием 10 см3 исследуемого материала центрифугируют при частоте вращения 25 с (1,5•103 об/мин.) 10 мин или при частоте вращения 50 с1 (3,0х103 об/мин.) 5 мин. Полностью сливают недостаточную жидкость и готовят препарат для микроскопирования.
Для определения количества клеток микроорганизмов в 1 см3 виноматериала производят подсчет в счетной камере. В каждом препарате подсчитывают клетки в пяти больших квадратах счетной камеры. Для облегчения подсчета клеток густые суспензии следует разбавлять водой с таким расчетом, чтобы в одном большом квадрате количество клеток не превышало 30.
Для достоверности определения числа клеток в 1 см3 отобранной пробы в счетной камере необходимо произвести их подсчет в таком количестве препаратов, чтобы общая сумма клеток была не менее 600. Так, если в пяти больших квадратах счетной камеры одного препарата содержится около 150 клеток, то нужно произвести подсчет еще в трех заново подготовленных препаратах, а затем рассчитать из четырех препаратов среднее количество клеток пяти больших квадратов счетной камеры.
Учет количества микроорганизмов в 1 см3 ориентировочно можно вести при микроскопировании препаратов раздавленной капли. Используют объектив 40х, окуляры 10х или 15х. Подсчитывают количество клеток микроорганизмов в пяти нолях зрения двух-трех препаратов, суммируют их число, определяют среднее пяти полей.
количество микроорганизмов (х) в одном 1 см3 исследуемого объекта как при подсчете в счетной камере, так и при ориентировочном подсчете в препарате раздавленной капли вычисляют по формуле
X А 50000 В,
где: А — количество клеток пяти больших квадратов;
В — кратное разведение исходной суспензии микроорганизмов;
50000 — коэффициент пересчета объема пяти больших квадратов на 1 см3
Ориентировочное определение систематических групп микроорганизмов производится по морфологическому признаку при микроскопировании. Предварительную, экспресс- ориентировочную оценку состояния виноматериалов дают на основании данных количественного учета микроорганизмов, используя табл. 14.
Таблица 14
Экспресс-оценка микробиологического состояния виноматериалов
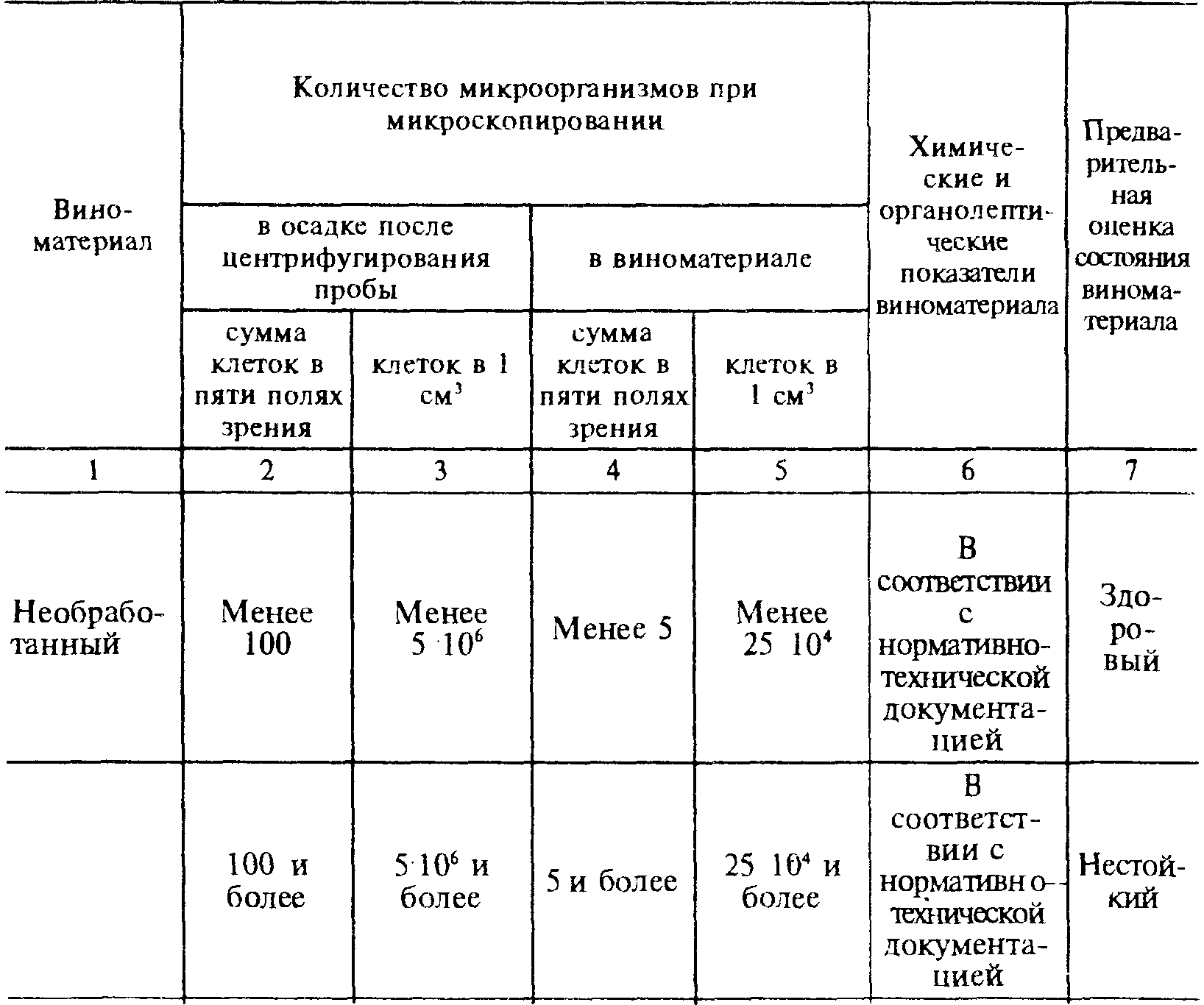
Виноматериал, оцененный как “больной”, немедленно обрабатывают по схеме: пастеризация (не менее 10 мин.) фильтрация→сульфитация (до содержания 25—30 мг/дм3 SO2 свободной). Обработанные таким образом виноматериалы подвергаются через сутки тщательному микробиологическому контролю (по табл. 15) и используются в производстве по заключению дегустационной комиссии.
При текущих микробиологических исследованиях в производственных условиях допускается ориентировочно-экспрессная оценка состояния виноматериалов (табл. 14) с использованием при микроскопировании препаратов “раздавленная капля” и с учетом химических и органолептических показателей.
Метод оценки микробиологической стойкости виноматериалов и вин
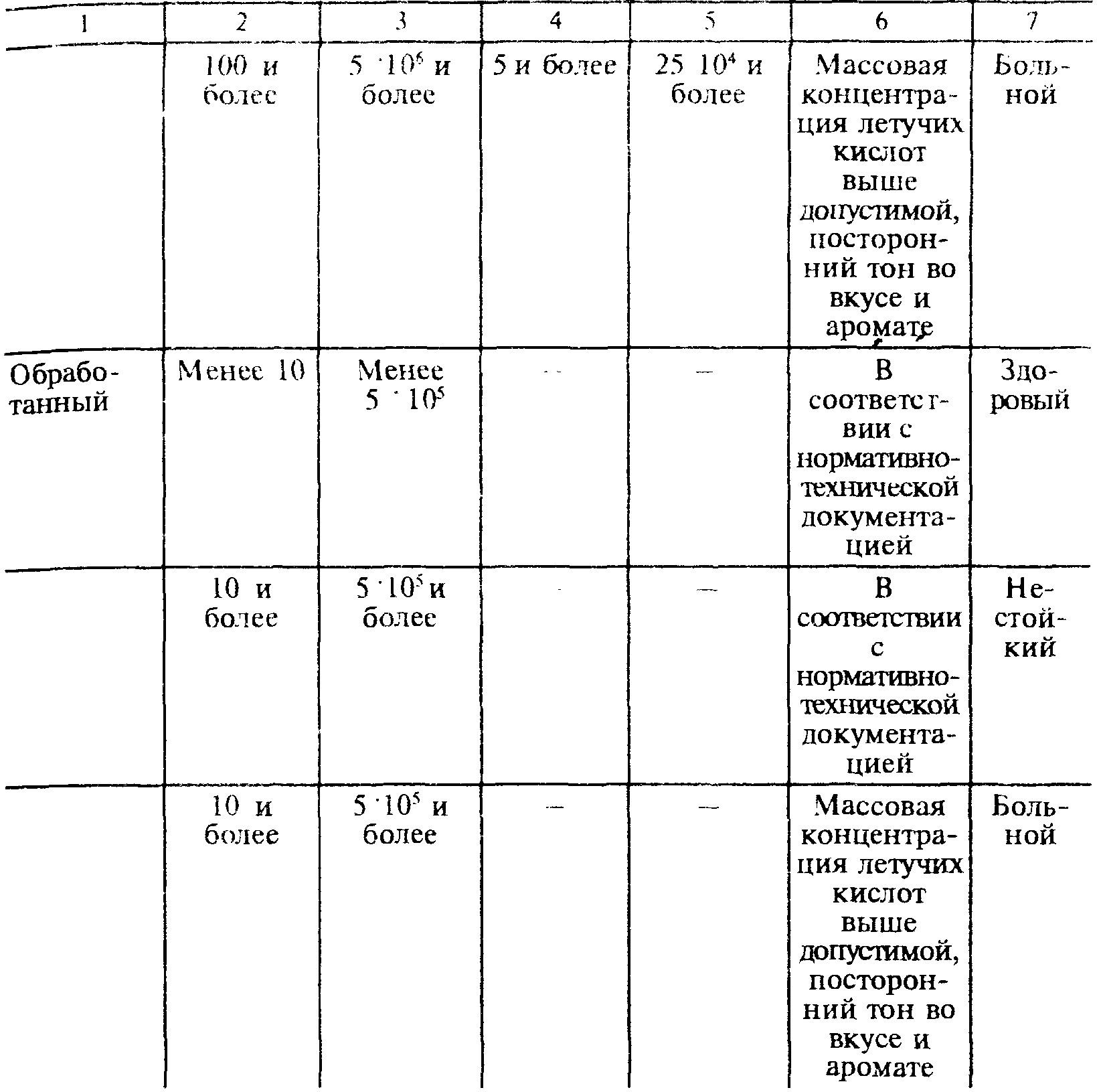
Микробиологическое состояние виноматериала проверяют после каждой обработки, а виноматериалы, находящиеся на выдержке и хранении — не менее одного раза в месяц. Основным методом оценки, микробиологической стойкости виноматериалов и вин является определение времени развития микроорганизмов в отобранной пробе, в элективных питательных средах и микроскопирование (табл. 15).
Виноматериалы и вина, инфицированные дрожжами и уксуснокислыми бактериями, выявляют по времени развития их в отобранной пробе. Для этого исследуемую пробу (10 см в стерильной пробирке с ватной пробкой помещают в термостат с температурой (26 ± 1)°С. Виноматериалы и вина, инфицированные молочнокислыми бактериями, выявляют по времени развития их после посева на элективные питательные среды. Исследуемую пробу в количестве 0,5 см3 высевают в одну из питательных сред: с сорбиновой кислотой или с этанолом. Посевы культивируют при температуре (26 ± 1)°С.
В качестве питательных сред используется солодовое сусло, яблочно-солодовое сусло, разбавленное виноградное сусло, капустная среда. Элективные для молочнокислых бактерий условия создаются добавлением в среду непосредственно перед посевом этилового спирта объемной долей 14% (0,95 мм на 5 мм среды).
Можно использовать также сочетание сорбиновой кислоты, подавляющей рост дрожжей, с созданием анаэробных условий для предотвращения развития уксуснокислых бактерий. Сорбиновая кислота используется в виде раствора с массовой концентрацией сорбата натрия 5 г/100 мл из расчета 0,2 мл на 10 л.
Анаэробные условия создаются с помощью агаровой пробки: после посева пробы в питательную среду по стенкам пробирки заливают расплавленный охлажденный до температуры 40—45°С водный агар с массовой концентрацией 2 г/100 мл. Высота пробки 2—2,5 см. На застывшую пробку наливают 1,0—1.5 мл спирта для предотвращения развития микроорганизмов на поверхности агара. При появлении роста остатки спирта сливают из пробирки, агаровую пробку удаляют или пробивают стеклянной палочкой и отбирают культуру для микроскопирования или пересева.
Оценка микробиологической стойкости виноматериалов и вин

Примечание: развитие молочнокислых бактерий при анализе высококислотных виноматериалов и вин свидетельствуют о прохождении яблочно-молочного брожения.
“Больным” или “нестойким” считается виноматериал или вино, в котором обнаружен рост хотя бы одного из указанных в таблице микроорганизмов.
Косвенным показателем больного вина является массовая концентрация летучих кислот, превышающая допустимую, а также посторонние тона при органолептической оценке.
Контроль за ходом яблочно-молочного брожения
Виноматериалы с высокой титруемой кислотностью и наличием молочнокислых бактерий типа кислотопонижателей проверяют на наличие яблочной и молочной кислот методом хроматографии на бумаге.
В качестве растворителя используют н-бутиловый спирт, 85%-ную муравьиную кислоту и воду в соотношении 4.1:5. Смесь взбалтывают в течение 10—15 мин в делительной воронке или колбе и оставляют на 1 сут для расслаивания. Для хроматографирования используют верхний слой. Проявитель 0,05%-ный раствор бромфенолового синего в 96%-ном спирте-ректификате, на каждые 250 мл растворителя добавляют 2 мл 0,1 н. раствора NaOH.
Для приготовления чистых растворов яблочной, молочной и винной кислот (свидетелей) растворяют по 30 мг каждой кислоты в 5 мл этилового спирта.
Из бумаги хроматографической ленинградской № 1 или фильтровальной вырезают круг по диаметру эксикатора. В центре его описывают другой круг диаметром 2 см, на который капилляром на расстоянии 1,5 см одна от другой наносят точки вина и растворов свидетелей. Размер пятна после этого должен быть не более 3 мм. В каждую точку растворы свидетелей наносят 5—6 раз, исследуемое вино — 6—8 раз после высыхания предыдущей капли.
После подсушивания бумажный круг кладут на чашку Петри, в которую налит растворитель, делают фитиль из бумаги, вставляют его в центр бумажного круга так, чтобы конец погружался в растворитель. Чашку Петри и бумажный круг помещают в эксикатор, который герметически закрывают крышкой. Через 60—90 мин, когда растворитель, поднимаясь по фитилю, пройдет по бумажному кругу 7—8 см, разделение считается законченным. После этого хроматограмму извлекают из эксикатора, высушивают в вытяжном шкафу до исчезновения запаха муравьиной кислоты и опрыскивают из пульверизатора проявителем. Свидетели органических кислот распределяются в следующем порядке от центра: винная, яблочная, молочная. В таком же порядке располагаются и пятна этих кислот для вина.
Наличие пятна яблочной кислоты и отсутствие молочной свидетельствуют о том, что процесс яблочно-молочного брожения еще не прошел, поэтому необходимо создать все условия, чтобы процесс биологического кислотопонижения завершился. Если этот процесс не завершился, вино нельзя считать биологически стабильным.
При благоприятных условиях может самопроизвольно возникнуть яблочно-молочное брожение и нарушится товарный вид продукции. О завершении процесса яблочно- молочного брожения судят по отсутствию пятна яблочной кислоты на хроматограммах.

