Как без понятия о pH трудно разобраться во всех вопросах, относящихся к кислотности и щелочности, так и без познания окислительно-восстановительного потенциала невозможно достаточно глубоко постигнуть явления, связанные с присутствием или отсутствием кислорода в растворе, например в вине, тем более что в вине эти процессы многообразны и имеют весьма важное значение.
За последние годы понятия об окислении и восстановлении подвергались пересмотру. Подобно тому, как были распределены кислоты и основания по их силе, выраженной константой диссоциации, точно так же были сгруппированы окислители и восстановители соответственно их интенсивности. Степень кислотности среды выражается символом pH, степень ее окисления выражают символом гН3.
Рассмотрим раствор, например вино, содержащее одно вещество (или несколько), находящееся частично в восстановленной, частично в окисленной форме, способное переходить из одной формы в другую (например, железо из состояния двухвалентного в трехвалентное). Поместим в этот раствор платиновую пластинку и присоединим полуэлемент, расположенный по отношению к другому полуэлементу как водородный электрод к каломельному электроду, причем жидкости связаны друг с другом мостиком, а металлические электроды — проводом. Устанавливают, что по проводнику проходит электрический ток и что образующаяся таким образом электродвижущая сила элемента, т. е. разность потенциалов на этих полюсах, если ток прекратился (что имеет место при противоположном способе), является лишь функцией соотношений восстановленных и окисленных форм и, стало быть, целиком зависит от степени окисления и восстановления раствора. Каковы бы ни были теоретические объяснения этого явления, о которых можно спорить, какова бы ни была методика изучения его сущности, экспериментальный факт налицо. Следует дать некоторые пояснения и определения.
3 Об этом см. Р. Сhоvin, Le potentiel d’oxydo-réduction, Paris, Gauthiers-Villars, 1943
Вспомним, что окисление растворенного и диссоциированного вещества не всегда выражается в присоединении кислорода или потере водорода (пример: окисление хлористого железа в хлорное), но что оно непременно сводится в конечном счете к потере отрицательных электрических зарядов, или электронов, и, следовательно, к уменьшению отрицательного заряда, если иметь в виду анион, или увеличению положительного заряда, если это касается катиона (пример: окисление железистого катиона Fe++ в железный катион Fe+++). Восстановление представляет собой обратное явление. Так как здесь имеет место передача электрических зарядов, представляется возможным прежде всего изучить при помощи электричества изменение систем, подобных вину, в которых протекают аналогичные реакции. Для этой цели нужно уловить с помощью соответствующего прибора эти электрические заряды, пропустить их через проводник и определить отдаваемую силу тока или, скорее, уровень (напряжение).
Какое-либо вещество, например железо, присутствующее в растворе одновременно в восстановленной и в окисленной формах при наличии их взаимопереходов благодаря обратимости, представляет собой окислительно-восстановительную систему. (Когда вино изолировано от доступа воздуха, и вещество в нем восстанавливается, тогда одновременно окисляется присутствующий восстановитель). Окислительно-восстановительным потенциалом раствора называют разность потенциалов, наблюдающуюся между платиновым электродом, погруженным в раствор, и нормальным водородным электродом (при давлении водорода, равном 1 атм), когда обе жидкости соединены соединительным мостиком. Нормальным потенциалом окислительно-восстановительной системы называют такой потенциал, при котором данная система наполовину окислена и наполовину восстановлена; нормальный потенциал зависит в основном от pH.
Чем сильнее окислена среда, например при проветривании, тем выше ее окислительно-восстановительный потенциал. Напротив, если вино сохраняется в отсутствии воздуха, то потенциал его постепенно понижается до определенной величины, которая называется предельным потенциалом.
В проветренном вине увеличение окислительно-восстановительного потенциала идет параллельно с окислением восстановительной системы и образованием промежуточных окислителей и определяется ею, а в вине в условиях отсутствия воздуха понижение потенциала протекает параллельно с исчезновением растворенного кислорода и восстановлением этих систем. Действительно, когда растворенный в вине кислород полностью исчезает или по крайней мере не улавливается при анализе, потенциал еще далеко не достигает своей предельной величины.
В дальнейшем мы сможем убедиться в том, что, независимо от теории, весьма примечателен тот факт, что потенциал платинового электрода, погруженного в вино, находится в прямой зависимости от степени аэрации этой жидкости. Этот потенциал составляет примерно 300—400 мв в проветренных винах и 100— 150 мв в винах, изолированных продолжительное время от притока воздуха при хранении в бутылках от нескольких месяцев до нескольких лет. Если вино, долго хранившееся без доступа воздуха, насыщается кислородом путем взбалтывания его на воздухе, то его потенциал постепенно повышается; вино не обесцвечивает метиленовую синь, и, как мы видели, эти свойства отнюдь не связаны только с присутствием растворенного кислорода, так как они не проявляются после растворения кислорода в вине.
Рассмотрим теперь какое-нибудь окислительно-восстановительное вещество, например железо или красящее вещество, присутствующее в таком растворе как вино и служащее индикатором окисления-восстановления. Это соединение наполовину окислено и наполовину восстановлено, когда потенциал вина равен нормальному потенциалу вещества. Если потенциал выше нормального, то преобладает окисленная форма и наоборот. В конечном счете вещество окисляется полностью, когда потенциал вина явно превышает на 100 или 200 мв нормальный потенциал вещества, и наоборот.
Например, в кислом растворе двухвалентного железа и трехвалентной соли доля трехвалентного железа возрастает следующим образом:
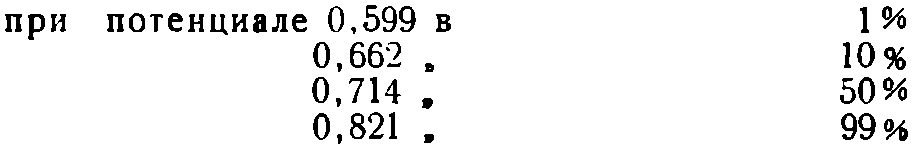
Нормальный потенциал равен 0,714, что как раз имеет место в том случае, когда железо не находится в какой-либо зависимости от pH. По существу, речь идет о соотношении ионов Fе+++ и Fе++. Но в вине основная часть железа, в особенности трехвалентного, присутствует в виде сложных, а не простых ионов Fе+++. Этим и объясняется тот факт, что проветренное вино может содержать значительное количество трехвалентного железа, хотя его потенциал достигает только 0,3—0,4.
Суммируя изложенное выше, можно сказать, что новое понимание окислительно-восстановительного потенциала позволяет:
- точно оценить окислительную и восстановительную способность любой среды;
- сгруппировать различные окислители и восстановители в виде стройной шкалы в соответствии с их нормальными окислительно-восстановительными потенциалами. В связи с этим необходимо заметить, что не существуют, собственно говоря, ни окислители, ни восстановители: всякое вещество является окислителем по отношению к таким соединениям, которые обладают повышенным нормальным потенциалом. Чем ниже нормальный потенциал вещества, тем легче оно окисляется и тем труднее восстанавливается (и наоборот);
- выяснить относительно той или иной окислительно-восстановительной системы, в какой степени она окислена и в какой мере восстановлена в данной среде;
- изучить состав среды с точки зрения окислительно-восстановительных систем, измеряя колебания ее потенциала под воздействием окислителей и восстановителей определенной силы и наличия.
Необходимо сделать следующее замечание.
Строго говоря, понятие окислительно-восстановительного потенциала применимо только к системам обратимым и обладающим равновесием. Проветренное вино, содержащее кислород, не находится в состоянии равновесия: в нем совершаются заметные превращения, поскольку исчезает кислород. Измеряемый потенциал является видимым потенциалом, легко поддающимся определению в данном вине и при данных конкретных условиях, но не всегда обладающим ясно выраженными показателями в отношении состояния содержащихся в вине восстановителей. Напротив, непроветренное вино представляет собой систему равновесия, по крайней мере практически, и предельный потенциал может служить точным показателем состояния, хотя величина этого предельного потенциала обусловлена, по-видимому, не только присутствием обратимых окислительно- восстановительных систем, но и наличием необратимых окисляемых веществ.
Понятие rH.
Введенное новое обозначение rH связано с потенциалом и pH следующим отношением, позволяющим исчислять его:
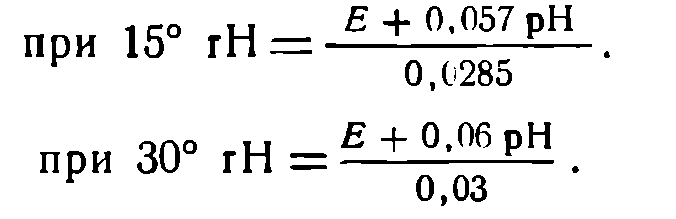
К данному выводу приводит предположение о наличии в растворе определенного количества газообразного водорода, находящегося под определенным давлением (впрочем, чрезвычайно слабым), образующего окислительно-восстановительную систему вместе с ионами Н+ раствора (представляющими окисленную форму водорода), причем эта система уравновешивается другими окислительно-восстановительными системами раствора.
Подобно тому, как pH представляет собой отрицательный логарифм концентрации ионов водорода rH выражает отрицательный логарифм давления газообразного водорода, истинного или мнимого, наблюдающегося в растворе окислительно-восстановительной системы.
Возьмем, например, раствор с pH 3 и окислительно-восстановительным потенциалом Е = 0,1 в (при 27°).
Отсюда выводим: ![]()
Однако если производить определение не тотчас же после насыщения, а несколькими часами позднее, то эти методы дают совершенно иные результаты: метод извлечения дает, например, не больше 4 мл/л, тогда как гидросульфит всегда дает 6 мл/л; и если произвести в этот момент дополнительное насыщение на воздухе, то извлечение даст 6 мл, гидросульфит 8 мл, цифру, превышающую коэффициент растворимости кислорода.
Таким образом, сравнение обоих способов обнаруживает в проветренном вине отклонение в данном случае на 2 мл кислорода, наличие которого не поддается установлению методом извлечения. Это явствует из разности цифр 8 и 6 мл, полученных при определении гидросульфитным методом и извлечением. Вытекающие отсюда выводы не зависят от абсолютной точности гидросульфитного метода, который требует поправки на присутствие спирта, так как результаты двух методов определения относятся к одному и тому же вину, имеющему, следовательно, одинаковую крепость, а влияние поправки на эту разницу ничтожно. Так как указанный метод дает на одном и том же образце одинаковые результаты (примерно на 3—4% согласно определению), то погрешность будет значительно меньше сравнительно с рассматриваемыми расхождениями, достигающими порядка 25%.
Эти совершенно бесспорные факты нетрудно объяснить: разница в 2 мл, наблюдающаяся в проветренном вине по истечении нескольких часов покоя, обусловлена не растворенным кислородом, а окисляемыми веществами, действующими на индиго-кармин, который обесцвечивается гидросульфитом точно так же, как кислородом.
Иначе говоря, непроветренное вино содержит вещества R, способные в присутствии растворенного кислорода присоединять к себе часть последнего и образовывать окислители, обозначаемые нами символом RО2 (которые мы ранее обозначали О3), хотя мы и не предрешаем вопроса о природе этих веществ, поскольку окисление R может заключаться как в потере водорода или увеличении положительного заряда, так и в присоединении кислорода.
Эти окислители, определяемые при помощи гидросульфита, возникают в процессе окисления благодаря присутствию растворенного кислорода, и когда вино вновь помещено в условия воздухонепроницаемости, они постепенно исчезают вместе с растворенным кислородом; образование этих веществ начинается с их восстановленной формы при обратимой реакции1
![]()
Итак, вино, когда оно начинает насыщаться кислородом, содержит R+О2; по прошествии некоторого времени в нем образуются ПОМИМО ЭТОГО еще соединения RO2.
что соответствует давлению водорода в 10-9,3, т. е. ничтожно малой величине. Из этого видно, что гН изменяется в том же направлении, что и потенциал. Условно принято считать, что гН 27 соответствует нейтральной среде с точки зрения окисления-восстановления.
Было отмечено, что символ гН менее полезен, чем обозначение pH ввиду того, что окислительно-восстановительная система отлично поддается определению, если известны ее pH и окислительно-восстановительный потенциал. Как бы то ни было, если даже предположение о существовании в воде и в водных растворах, подобных вину, некоторого весьма незначительного количества свободного водорода (который якобы уравновешивается определенным количеством газообразного кислорода) и не соответствует действительности, величина rH, получаемая непосредственно в результате вычислений таких величин как потенциал, может быть использована в качестве удобного понятия.

